免费下载《徕卡应用专刊:STED技术历史和原理介绍》
在生命科学发展的历程中,显微镜技术的作用至关重要,尤其是早期显微技术领域的某些重要发现,直接促成了细胞生物学及其相关学科的突破性发展。随着生命科学的研究由整个物种发展到分子水平,显微镜的空间分辨率及鉴别精微细节的能力已经成为一个非常关键的技术问题。光学显微镜的发展史就是人类不断挑战分辨率极限的历史。
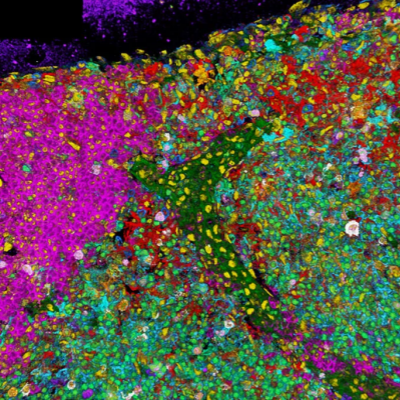
自从1873年德国物理学家恩斯特-阿贝(Ernst Abbe)第一次发现光学成像具有衍射限制现象以来,物理学界就公认,显微镜的分辨率具有极限,该极限与光源的波长有关(图1)。在400~760nm的可见光范围内,显微镜的分辨极限大约是光波的半个波长,约为200nm。一直以来,200nm的“阿贝极限”一直被认为是光学显微镜理论上的分辨率极限,光学显微镜对于小于200nm的结构观察(如细胞器内部的精细结构、病毒颗粒和蛋白复合物等等)无能为力(图2),必须借助电子显微镜或隧道扫描显微镜才能观察。

图1、传统光学显微镜的分辨率公式及阿贝极限,当两个物体之间的间距小于200nm即无法分辨
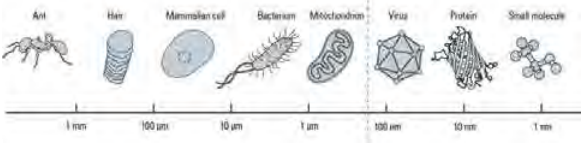
图2、200nm阿贝极限与生物体中的各种结构尺寸
直到一个多世纪之后,罗马尼亚物理学家Stefan Hell应用STED( stimulated emissiondepletion ,受激发射损耗,图4和图5)技术推翻了这一观点。他是首位不仅从理论上论证了,而且用实验证明了使用光学显微镜能达到纳米级分辨率的科学家。Stefan Hell凭借STED的发明,获得了2006年度的德国“未来奖”这一科学荣誉。2008年,《Nature》杂志将包括STED在内的超高分辨率显微技术评为年度技术。2014年,Stefan Hell因发明STED等超高分辨率技术荣获诺贝尔化学奖(图3)。
生物科学研究离不开超高分辨率显微术的技术支撑,人们迫切需要更新显微术来适应时代发展的要求,借助显微镜从纳米水平上对细胞内的结构及活动过程进行真实的观察能让人们发现许多以往所不了解的东西。徕卡作为超高分辨率成像领域的技术领航者,早在2004年就推出了全球第一款超高分辨率4Pi显微镜(图6)。2007年,徕卡非常具有前瞻性地开始对STED技术进行商业化生产,并在此基础上不断推陈出新,突破极限。
徕卡STED以成像卓越的SP8共聚焦为搭载平台,是目前唯一一种能在共聚焦平台上以纯光学方法实现超高分辨率成像的显微技术。在Vortex和z-Donut等光学部件的作用下,STED损耗激光能量在焦平面呈圆环状分布,使其外周发生受激发射,从而使得有效的荧光检测区域大大缩小,从而分别提高了xy以及z轴方向的分辨率(图7)。
徕卡STED 主要分为STED CW和Gated STED(或称gSTED)。STED CW以TCS SP8 常规共聚焦为平台,固定谱线的连续激光为光源,xy分辨率≤80nm,z轴分辨率≤170nm。Gated STED以TCSSP8 X脉冲式的白激光共聚焦为平台,结合Lightgate时间门控技术,xy分辨率≤50nm,z轴分辨率≤130nm(图8和图9)。在理想条件下,xy分辨率可以达到30nm。由于STED是以纯光学方法实现超高成像,其原始数据经过SVI公司专业的Huygens反卷积软件计算,可将分辨率进一步提高2倍以上(图10).