沈博实验室利用半骨透明化技术揭示骨髓移植后神经促进造血干细胞和血管再生的机制
北京生命科学研究所(NIBS)/清华大学生物医学交叉研究院沈博实验室发现外周神经和LepR+细胞(LepR阳性间充质细胞)通过相互作用促进骨髓移植后造血和血管系统的再生。
造血干细胞是我们身体中几乎所有血细胞的来源,它们存在于骨髓中独特的微环境里。骨髓中分布着丰富的外周神经。造血干细胞领域内之前的研究通过手术横断、化学药物消融等方法消融神经,探索了骨髓内外周神经对于造血干细胞的维持、迁移和再生等生命活动的潜在作用,但是由于不同的骨髓内外周神经消融手段导致的实验结果并不完全一致,所以目前对于骨髓内外周神经对造血干细胞的功能仍旧存在争议。
2023年11月27日,北京生命科学研究所(NIBS)/清华大学生物医学交叉研究院沈博实验室,与美国西南医学中心/霍华德休斯研究所Sean Morrison院士实验室合作,在Nature Cell Biology杂志发表了文章 “Leptin receptor+ cells promote bone marrow innervation and regeneration by synthesizing nerve growth factor”。该研究使用半骨透明化技术进行深度成像,揭示了骨髓内外周神经通过促进LepR+细胞释放生长因子来促进骨髓再生。沈博实验室PTN项目,北京大学前沿交叉学科研究院博士生高祥为本论文的第一作者。沈博研究员和Sean Morrison院士为本论文的共同通讯作者。本论文的其他作者还包括沈博实验室的倪悦涵(北京师范大学生命科学学院)、杨敏(北京师范大学生命科学学院)、张祎旋、郭嘉茗(PTN项目,北京大学前沿交叉学科研究院),以及中国药科大学的方慎彤教授。本研究得到了国家自然科学基金委、北京生命科学研究所的资助。

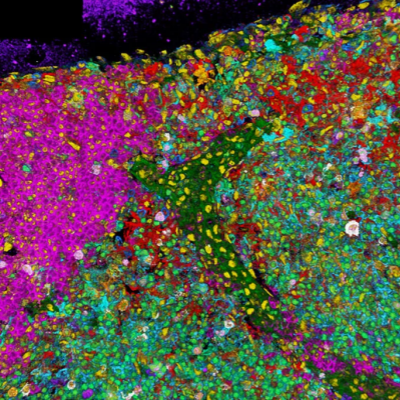
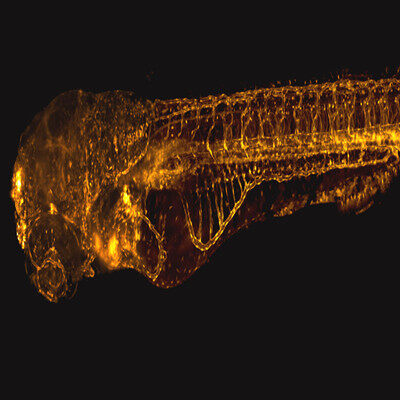
在本研究中,沈博实验室使用了一种半骨透明化成像技术,可以保留骨组织完整的三维结构对半骨进行深度成像。该实验方法可以对半骨或其他多种组织进行多组合的抗体荧光标记。制备完成后的半骨可以使用Leica Stellairis 8 DIVE成像并通过相关软件对获得的图像进行定性或定量的分析。
在这项工作中,作者首先通过分析测序数据发现骨髓内主要仅表达单一的一种神经生长因子Nerve Growth Factor(NGF),而且主要由 LepR 阳性间充质细胞(LepR+细胞)表达。作者构建了NgfmScarlet/+报告小鼠,使用半骨透明化技术进行深度成像,证明了这一发现(图1):Ngf-mScarlet+细胞主要分布在Endomucinhigh的血窦和Endomucinlow的小动脉周围。骨髓中存在密度更高的血窦,意味着Ngf-mScarlet+细胞主要分布在血窦周围,这些血窦周围的细胞是LepR+细胞。测序数据表明,图中小动脉周围的Ngf-mScarlet+细胞主要是LepR+Osteolectin+细胞和平滑肌细胞。
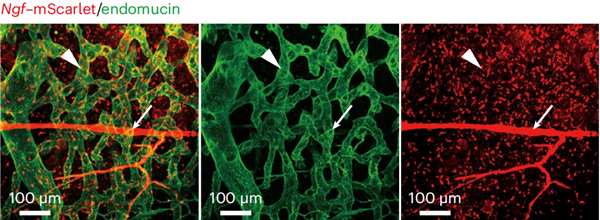
图1.成年NgfmScarlet/+小鼠股骨骨髓的深度成像。Ngf-mScarlet+细胞主要分布在Endomucinhigh的血窦(箭头)和Endomucinlow的小动脉周围(长箭头)。
接下来,沈博实验室构建了骨髓内外周神经特异性消融的小鼠模型(去神经小鼠):他们使用半骨透明化技术发现六月龄的Leprcre;Ngffl/-小鼠骨髓中外周神经纤维完全消失而髓外外周神经并没有受到影响(图2)。这些结果表明,LepR+细胞合成的NGF对骨髓内神经的维持十分重要。进一步的实验显示,去神经小鼠的造血干祖细胞及血液系统在稳态维持情况下功能完全正常,说明骨髓内造血干祖细胞的维持不依赖于髓内外周神经。

图2. 6-8月龄Leprcre; Ngffl/-小鼠和Ngffl/-同窝对照小鼠股骨骨髓的深度成像
进一步的研究表明,骨髓内LepR+细胞及分化的脂肪细胞在骨髓移植前的辐射清髓后增加了NGF的释放,导致骨髓内外周神经纤维增多并通过刺激LepR+细胞释放更多的生长因子(比如SCF,VEGF,和Ang2)促进造血和血管系统的再生。机制上,外周神经通过释放神经递质激活LepR+细胞中的b2和b3肾上腺素能受体通路,刺激该细胞释放多种生长因子以促进造血和血管系统的再生。在LepR+细胞中条件性敲除编码b2和b3肾上腺素能受体的基因Adrb2和Adrb3抑制了LepR+释放SCF等生长因子,并阻碍了造血和血管系统的恢复。
综上所述,外周神经和LepR+细胞通过相互作用促进骨髓移植后造血和血管系统的再生,其中LepR+细胞通过合成NGF促进骨髓神经的维持及其清髓后的生长,而骨髓神经通过刺激LepR+细胞释放多种生长因子来促进骨髓再生(见图3)。本研究为造血干细胞移植以及白血病等血液疾病的临床治疗提供了重要参考。
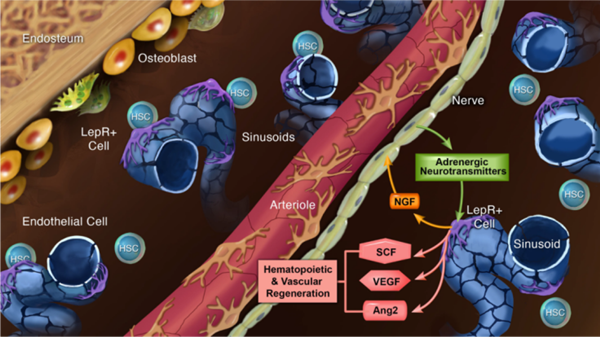
图3.骨髓内外周神经和LepR+细胞通过相互作用促进骨髓造血和血管系统的再生