徕卡共聚焦课堂第6讲:光谱成像
分色方法
多通道荧光成像的目的是将各种荧光染料发射的光子收集到独立的检测通道中。为此,有必要对全发射光谱的组分进行空间分离,即将这些组分定位到不同的方向。传统上,这种分离是通过“次级二向色镜”(将照明与发射分离的主要分光器,称“主分光器”)进行的。出乎意料的是,还可以通过使用棱镜(首选)或光栅来分离。根据光子的颜色对光子进行物理分类,这是一种原始的真彩分色方法。如果主要分色不充分,则可以通过数学分解来补充。
次级二向色镜
自1970年以来,多通道荧光显微技术在生物显微技术领域的需求日益增加。在最简单的情况下,用于单通道设置的滤光片和二向色镜在本质上允许记录例如,蓝色或紫外线激发下的绿色和黄色/橙色荧光(当时被遗忘的标准是富尔根染色,它可以通过不同的发射颜色来辨别和)。宽场显微技术通过使用彩色摄像机来达到这一要求。有时,特别是对于定量测量,图像被分割,两个通道在同一芯片上并行成像。最先进的是同时并行使用两个或多个摄像机。在真共聚焦扫描显微技术中,不可能分割感应目标。因此,通过添加第二个(第三个……)光电倍增管,立即实现了多通道荧光成像。并行记录数据,数据可以直接显示在屏幕上,例如,在监视器的3个颜色通道中,或以电子方式存储以供以后分析。要显示3个以上的通道,信息必须分布在3个可用的监视器通道中,这不可避免地会导致分离度和强度分辨率的损失。然而,现代显微技术不仅仅能得到清晰的图像(无论如何,我们用肉眼只能辨别三个通道),还可以对其进行定量测量。在定量测量中,只要通道数量不超过样品中荧光染料物质的数量,任何数量的通道都是有意义的。
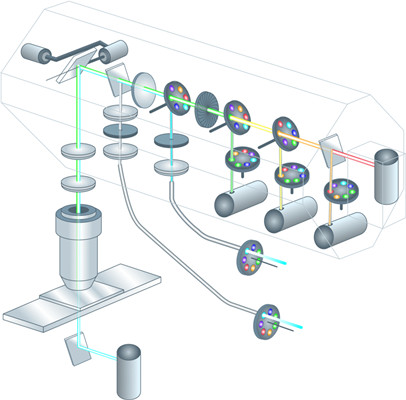
图1:带有次级二向色镜的4通道共聚焦扫描显微镜的布局图(徕卡 ,1995年)。1和2设计为“滤光片轮”,而是固定反射镜(适用于3通道系统)或固定二向色镜(适用于4通道系统)。
将发射不同颜色的荧光染料发射到一组传感器,最显而易见的方法是使用二向色镜。二向色镜会反射比二向色指定波长0更短波长的光,并能透射更长波长的所有颜色的光。这适用于“长通二向色镜”。“短通二向色镜”会透射较短波长的光并反射光谱中较红部分的光。在图2中,一组三个次级二向色镜1、2和3用于将全光谱分成4个不同的方向,传感器随后可以在其中收集4个不同的通道。必须根据所用荧光染料的光谱发射特性来选择次级二向色镜。因此,给定的一组次级二向色镜可能适合许多发射方式类似的荧光染料,但如果荧光染料组合的发射特性显著不同,则不适用。为解决这一问题,使用次级二向色镜进行分色的系统在每个分色位置都配备了片轮或滑块。它们配备了一系列不同的二向色镜,允许(有限)数量的不同色带传递给传感器。显然,这种解决方案不是很灵活,需要大量的伺服技术和调整(预计至少保持稳定数月。如果安装许多激光线,则潜在发射带的数量将会增加——因此需要的次级二向色镜的数量也会增加。如果使用白激光,发射滤光片概念将无法合理适应,只能使用连续可调的设备。图1表明了1995年次级二向色概念的实现。
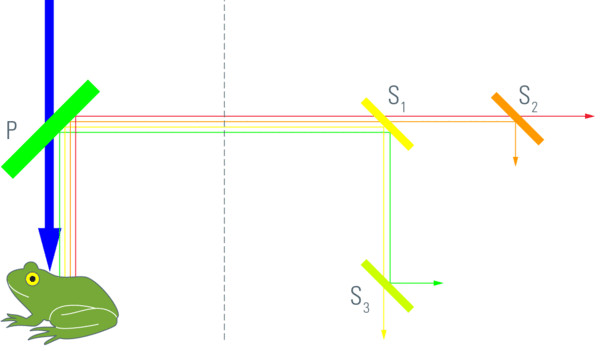
图2:二向色镜的色散。主分光器将激发与发射分离。随后通过次级二向色镜1、2和3将发射分成四个方向(本例)。常规二向色镜反射短波长的光并透射“更红”颜色的光,尽管相反的特性也同样可能。
棱镜的色散
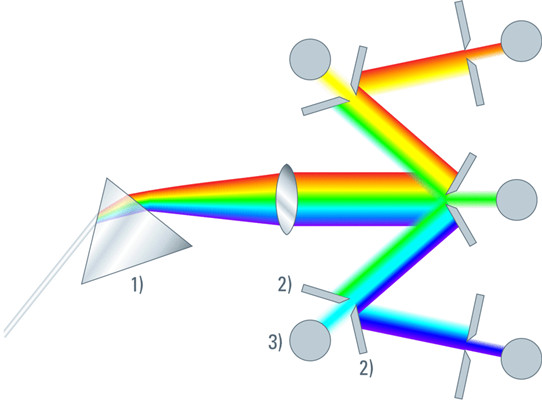
图3:基于棱镜的共聚焦检测模块示意图,该模块具有可单独调节波段的5个通道,用于发射收集。
1)棱镜,2)滑块,3)检测器
艾萨克·牛顿爵士在其1704年出版的《光学》一书中描述了最古老的(有目的的)光分色方法:使用棱镜。本文的序言部分附有牛顿那本书的插图。我们如今的解释是,在不同光学介质的边界处,较短波长的光将比较长波长的光的衍射更强(作出一个简单的结论)。如果将不同颜色混合后(如一组荧光染料组合发射),穿过棱镜,则组合发射将在光谱上分解。
分解强度取决于多个技术参数,但与样品或传感器无关。这是一个非常有效和直接的解决方案,可以让一组荧光染料发射指向不同方向,这样就可以记录下来。在最简单的情况下,只需沿着光谱放置一系列检测器。这一概念已经实现了,但在收集效率和灵活性方面还存在严重缺陷。多波段设备是更好的解决方案,对每个要记录的传感器,其允许单独选择全光谱的任何部分。
棱镜具有全光谱(平面)透射的优势,即棱镜(在指定的光谱范围内)没有吸收调制。透射和色散与偏振方向无关。这是一个重要的定律,因为荧光染料的发射总是非偏振的。最后但并非最不重要的是,色散仅发生在一个方向上——在选择的阶数中,没有其他“阶数”可以降低色散的强度。
本文对色散光谱的线性问题进行了讨论。基于棱镜的光谱与波长不呈线性关系。这对于技术设计而言不是问题,只要不使用线性检测器组合,例如多阳极光电倍增管或类似设备。

图4:棱镜的色散。由于玻璃棱镜的折射能力取决于衍射光的波长,因此不同波长的组合将被分散。在白光的情况下,色散图案是一个连续的光谱。多重标记荧光样品的发射将产生一个在荧光染料发射最大值处具有最大值的光谱。这一技术是通过单个传感器收集尽可能多的单一染料。
光栅色散
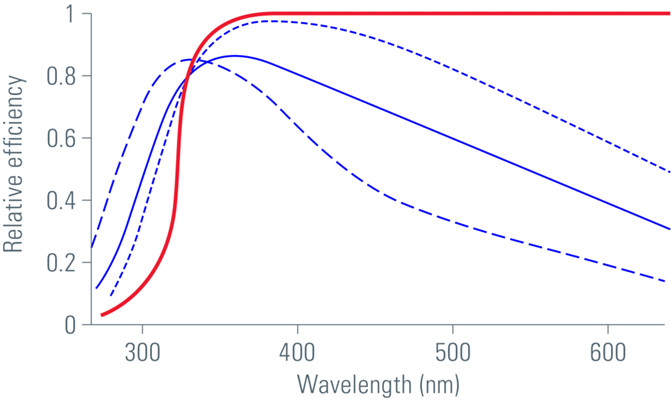
图5:光栅与棱镜的效率比较。光栅(蓝色曲线)针对“闪耀”波长进行了优化,该波长两侧的效率都会下降。而且,特定的偏振方向的透过效率很好(在闪耀时)。在短波段内,垂直偏振显著下降。棱镜的效率主要取决于所使用的玻璃类型,并且在长程范围内是平面且非偏振的(此处:用于可见光发射的冕玻璃)。
棱镜的另一个色散元件是光栅。透射光栅和反射光栅都在使用。用入射光束照明时,光栅的周期性结构将使光偏转到不同方向(通过干涉过程)。
直线方向(0阶)不显示任何色散。通常选择的方向是一阶。在这里,光分散为光谱,非常类似于棱镜中的色散。然而,还有更多的阶数,如2阶和更高阶,但在光栅法线的另一侧,也有反射1阶……阶。光栅制作技术是将尽可能多的能量集中在一个单一的阶数中。
对于平行或垂直于线(凹槽)方向的偏振光,光栅的表现也迥然不同。虽然垂直波在最佳情况(取决于各种参数)下可以产生相当有效的光谱,但平行波在距离闪耀波长两个八度范围内显著下降——大约降为零。由于荧光是非偏振的,因此用垂直效率和平行效率的平均值来描述总效率。在可见光200 范围内,下降到30%是常见的。
对于效率(光子收集性能)是关键问题的仪器而言,这使得光栅成为非常低效且不合适的色散器件——在共聚焦荧光显微技术中也是如此。如果该技术实现,通常会附加一系列额外的设计元件,试图引导丢失的光子进入传感器(有时称为“光子回收器”)。
更复杂的是,与棱镜相比,光栅的杂散光损失要大得多。
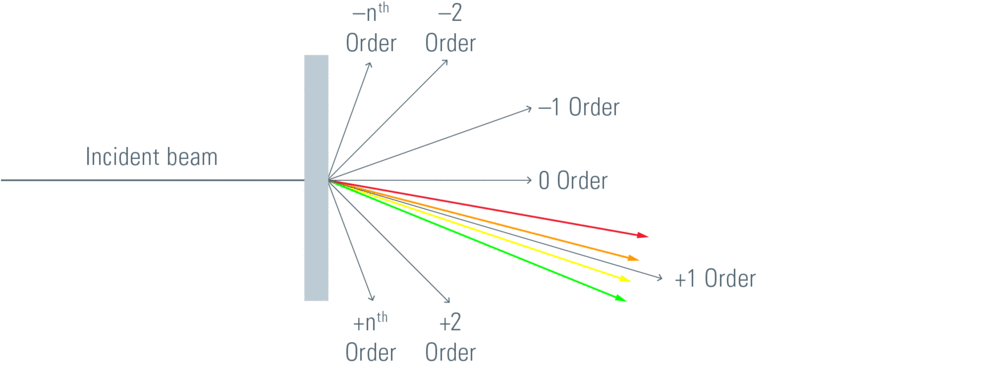
图6:光栅产生包含入射光束光谱的若干阶数。通过所用的阶数与入射光束的比值来计算绝对效率。
色散器的比较
如上文所述,在共聚焦显微技术中,荧光发射色散的各种概念各有优缺点。比较概述如下表所示。显然,棱镜是完成这项任务的最佳选择。
棱镜 |
光栅 |
二向色镜 | |
透射 | 0.75:0.9(闪耀)-0.6(红色) | 0.9(光谱部) | |
透射 | 0.6: 0.8(闪耀)-0.4(红色) | 0.9(光谱部) | |
透射 |
白色 |
闪耀不同 |
规格不同 |
高阶损失 |
否 |
是 |
否 |
全光谱检测 |
是 |
是 | 否(边缘不是无限陡峭) |
与设置无关 |
是 |
是 | 否(色散取决于实际元件) |
机械稳定 |
是 |
是 | 否(片轮,滑块……) |
杂散光问题 |
低 |
高 |
低 |