如何巧妙使用荧光寿命?看看大牛实验室怎么做的
徕卡显微系统 蒋玉立
荧光寿命的概念
荧光寿命是荧光分子在激发态停留的时间,这个时间可以反映荧光分子的内在属性和所处的微环境,是一个很有用的工具。以往,荧光寿命的测量和计算是件非常复杂和耗时的工作,只有少数专业的科学家关注和使用该工具。最近几年,随着新技术的发展,荧光寿命数据的获得越来越容易,也被更多的生命科学领域科学家来利用荧光寿命进行实验设计德国马普医学研究所的Kai Johnsson研究组长期致力于开发新的蛋白质标记技术,近期,他们利用荧光寿命来辅助开发新的蛋白标记,在2021年4月在BioRxiv上刊发了题为“HaloTag9: an engineered protein tag to improve fluorophore performance”的研究论文。
俗话说巧妇难为无米之炊,科学实验第一步就是拿到好的材料。作者锁定了常用的标签蛋白Halo7,将其改造成了寿命更长的Halo9。
Halo9的前世今生:
Halo7标签蛋白由于其分子量小、易于表达、无生物毒性等优点被广泛应用在原核和真核表达系统中。将Halo7标签蛋白与目的蛋白重组后,用带有氯代烷烃的荧光配基与Halo蛋白发生脱卤素反应形成酰胺键共价结合,即可实现荧光配基对目的蛋白的标记(图1A和1B)。
该实验室用点饱和突变的方式对Halo7进行了改造,筛选得到的Halo9与荧光配基MaP618结合后,荧光强度较Halo7增加了近百分之四十。更为重要的是荧光寿命发生了改变,从3.1ns(HaloTag7-MaP618)提升到3.7ns(HaloTag9-MaP618)(图1D)。

图1 Halo标签蛋白工作原理及改造示意图
材料拿到之后,我们看下作者是如何利用荧光寿命技术对这来之不易的材料玩出新花样的吧。
花样一:根据荧光寿命进行光谱之外的拆分
Halo7与Halo9联用实现单通道多色成像
作者构建了H2B-HaloTag7与 Tommo20-HaloTag9融合表达细胞系,使用MaP555-CA来同时标记HaloTag7与HaloTag9,用MaP555-Actin来标记F-actin, 而MaP555-Actin与MaP555光谱相同,所以系统仅采用一个光谱通道完成图像采集,再通过Phasor根据荧光寿命拆分出三个通道,分别是MaP555-CA-H2B-HaloTag7标记的细胞核、MaP555-CA-Tommo20-HaloTag9标记的线粒体和MaP555-Actin标记的细胞骨架(图2)。
这样设计的优势在哪里呢?传统的多色成像实验根据光谱差异来设计,会有串色等限制,而且需要多次采集图像,会造成样品的光损伤。通过荧光寿命来进行成像,仅需要拍摄一次就完成图像采集,不仅减少了成像时间,而且降低了激光对样品的损伤。

图2 单通道三色荧光成像
绿色,H2B-Halo7标记细胞核;紫色,Tomm20-Halo9标记线粒体;蓝色,MaP555-Actin标记微丝。Halo7与Halo9配基均为MaP555-CA。Ex:550,Em:570-620。
花样二:利用荧光寿命进行超高分辨成像——TauSTED
H2B-HaloTag7与 Tommo20-HaloTag9融合表达细胞系构建成功后,作者对该细胞做了STED超高分辨成像。由于只用了一个染料MaP555去同时标记HaloTag7与HaloTag9, STED成像时仅需要一次depletion过程就完成图像采集。后期通过Phasor云图将H2B和Tomm20的未受受激辐射的长寿命的光子分离出来,即得到背景更纯净的双色STED图像(图3)。
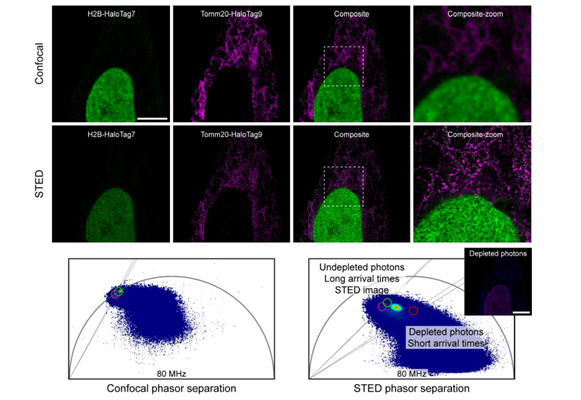
图3 单通道TauSTED双色成像
第一行,共聚焦成像结果;第二行,TauSTED成像结果;第三行 ,共聚焦与TauSTED成像Phasor图对比。绿色,H2B-Halo7标记细胞核;紫色,Tomm20-Halo9标记线粒体,配基均为MaP618-CA。Ex:615,Em:630-760。
技术盘点——TauSTED
STED技术通过一束环形的STED激光来干涉荧光衍射环的外圈发生受激辐射从而产生擦除效果,从而突破衍射极限实现超高分辨率成像。TauSTED技术创造性地将STED与荧光寿命技术结合,XY分辨率可达到30nm,获得高分辨率的同时可显著降低STED激光强度保护样本。TauSTED特别适合应用于组织和细胞内微小结构和物质的观察,如膜蛋白与膜微结构域、细胞器内部的微小结构观察、细胞骨架结构、蛋白复合物等。
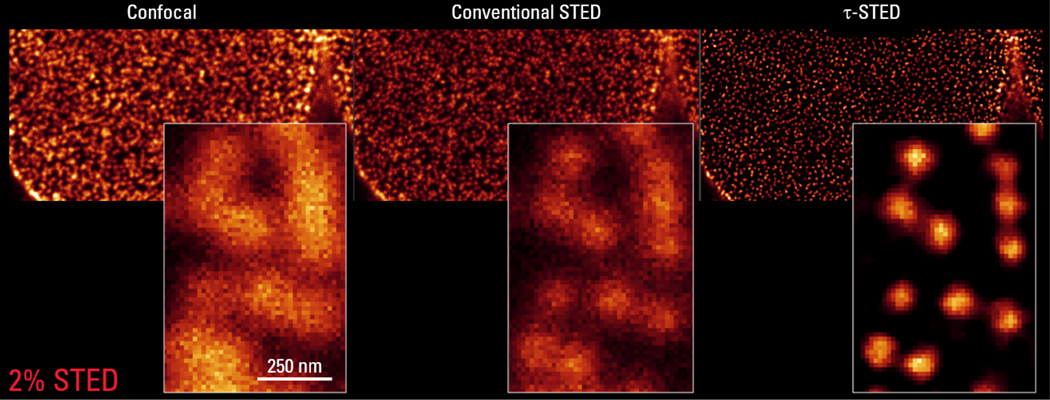
图4 TauSTED成像对比
从左往右,传统共聚焦成像,2%STED激光强度传统STED成像,2%STED激光强度TauSTED成像。
花样三:利用荧光寿命技术改造Biosensor
Fucci(Fluorescent Ubiquitination-based Cell Cycle Indicator)是一种监测细胞周期的biosensor。Fucci(CA) 将细胞周期依赖性的降解片段hCdt与hGem分别连接绿色和红色荧光蛋白,根据得到的两种荧光蛋白的强度比例来区分四种不同的细胞周期G1期、S期、G2期和M期。作者将此biosensor中的两种荧光蛋白分别用HaloTag7和HaloTag9进行置换,根据此两种Tag荧光寿命的不同来指示细胞周期,构建了基于荧光寿命成像的Fucci(CA) -LT。
作者使用TauSense工具测得HT7-hGem的AAT(Average photon arrival time,平均光子到达时间)较短,用于指示S期,HT9-hCdt的AAT较长,用于指示G1期,而G2和M期混杂了两种成分,测得的AAT处于中间水平(图5A)。由于HaloTag可以用不同的染料进行标记,Fucci(CA)-LT构建成功之后,实验人员可以任意更换与HaloTag搭配的不同颜色的探针,灵活性更强。此外,作者还将TauSense测得的图与FastFLIM测得的图进行了对比(图5B),结果显示两种测量方法的一致性很高。对比基于光谱的Fucci(CA),基于荧光寿命的Fucci(CA)-LT只需要一个成像通道就完成实验,光毒性较Fucci(CA)降低了一半,在长时间活细胞成像中更具有优势(视频1)。
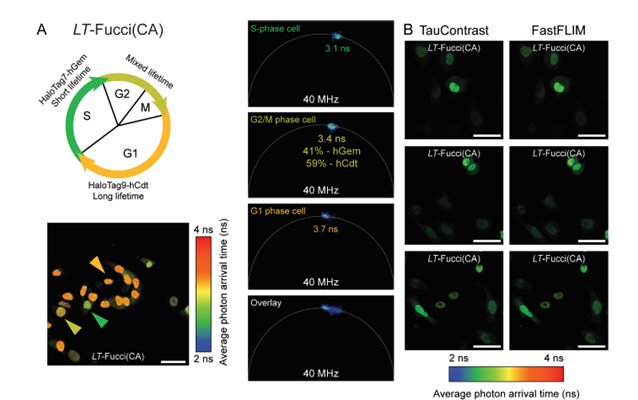
图5 基于荧光寿命构建Fucci(CA)biosensor,追踪细胞周期
A,Fucci(CA)-LT工作原理示意;B,Fucci(CA)-LT 指示细胞周期,TauContrast与FastFLIM测量结果对比,无明显差异。
技术盘点——TauSense
TauSense用平均光子到达时间(Average photon arrival time,AAT)来指示荧光寿命,使用简单,方便快捷,不需要进行参数调节,帮助您快速挖掘样品荧光寿命信息。它包含三个子工具,TauContrast可以一键获取样品的荧光强度信息和寿命信息,用于监测细胞周期变化、离子浓度的变化、组织的代谢变化等;TauGating根据AAT的长短来设置时间窗口,可以将样品中短寿命的自发荧光、杂散光等去除掉;TauSeparation基于AAT的区别将检测到的信号进行拆分,即使所用的染料发射光谱完全重合,TauSeparation也能将其拆分成多个通道。

图6 用TauGating去除拟南芥叶片细胞壁自发荧光
左图:普通模式成像;右图:TauGating成像。红色:叶绿体;绿色:线粒体;门控窗口:0.3-12ns。
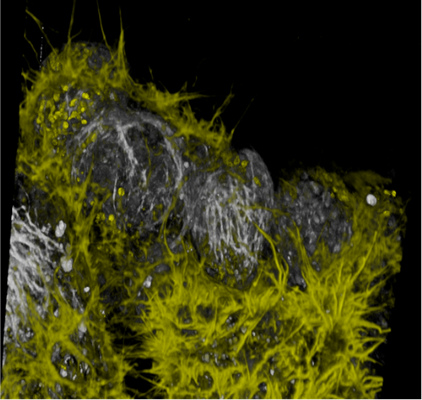
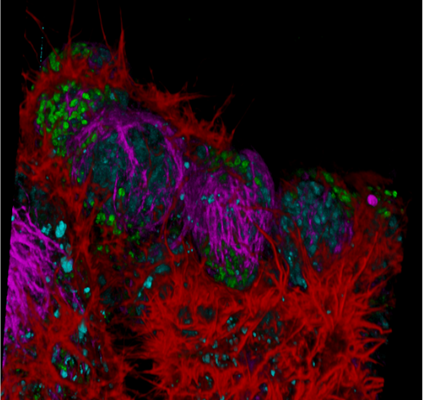
图7 TauSeparation技术用于NE-115细胞双通道四色成像
左图:灰色,NUC Red(细胞核)和SiR-tubulin(微管);黄色,Act-mNeoGreen(微丝)和MitoTracker Green(线粒体),光谱两两串色不可拆分。右图:蓝色,NUC Red(细胞核);洋红色,SiR-tublin(微管);红色,Act-mNeonGreen(微丝);绿色,MitoTracker Green(线粒体)。
总结
本论文通过改造HaloTag7得到了寿命更长的HaloTag9,HaloTag7与HaloTag9联合使用,仅需要一种染料标记即可实现多色成像。用此种方法进行TauSTED成像时,可通过phasor将荧光寿命进行拆分,一次depletion过程完成双色STED成像,减少了光损伤。用此方法构建的Fucci(CA)-LT biosensor监测细胞周期,可以自由选择荧光配基的种类,应用更灵活。
科研小灵感:
标签蛋白何其多,biosensor何其多。选取一个切入点,开动脑筋改一改,荧光寿命技术用起来,说不定就成功了呢?
参考文献
【1】Deo, C. et al. The HaloTag as a general scaffold for far-red tunable chemigenetic indicators. Nat. Chem. Biol. (2021). doi:10.1038/s41589-021-00775-w
【2】Digman, M. A., Caiolfa, V. R., Zamai, M. & Gratton, E. The phasor approach to fluorescence lifetime imaging analysis. Biophys. J. 94, L14–L16 (2008).
【3】Roberti, M. J. et al. TauSense: a fluorescence lifetime-based tool set for everyday imaging. Nat. Methods (2020).
【4】Shirmanova, M. V et al. FUCCI-Red: a single-color cell cycle indicator for fluorescence lifetime imaging. Cell. Mol. Life Sci. (2021). doi:10.1007/s00018-020-03712-7