冷冻光电联用(Cryo-CLEM)之旅
Cryo CLEM究竟是什么以及为什么它可以帮助科学家获得更深入的洞察
本文主要介绍Cryo-CLEM技术及其为科学家带来的便益。此外,还特别说明了一些相关文献。
近期在冷冻电子显微镜工作流程领域取得的技术进步,让我们能够获取到细胞蛋白质社会学的3D数据,其分辨率更是达到前所未有的1纳米以下。工作流程中有一个步骤,需要从样品获取目标位置纳米级分辨率的图像,而要得到这样的结果,就需要用到冷冻光学显微镜。这种显微镜如果用于低温电子显微镜工作流程,通常就称为Cryo CLEM。
在使用冷冻电子显微镜,特别是冷冻断层扫描时,为确保工作流程可以稳定生成所需的数据,冷冻光学显微镜是检查样本质量并识别目标位点的重要工具。这里,我们总结了当前可用的cryo-CLEM解决方案,包括所用技术的一些背景、典型的工作流程步骤,和已发表的科学成果。
徕卡显微系统的Cryo CLEM
徕卡显微系统的理念“见微知著,洞见未来”已经清晰表明:人类的发展离不开我们的视觉。我见,故我信。一图胜千言。为了探索生命的真相,或者更好地观察科学样本,一旦样本或其有趣的内容小于厘米级别,显微镜是首选。因为样本太小了,仅靠裸眼无法观察。

图1:样本的大小以及适用的观察技术。
显微镜技术
不同类型的显微镜有助于观察特定尺寸范围内的特定样本。光学显微镜包括体视荧光显微镜、宏观显微镜、荧光显微镜、共聚焦显微镜,具有许多提高分辨率、对比度等的技巧。然而,所有这些光学显微镜在放大倍率方面都有限制。在这方面,电子显微镜可以大显身手,可以看到更小的结构,这些结构对于光学显微镜来说无能为力。光学和电子显微镜这两个领域一直在突破新的界限,也必将在未来有更长足的进展。
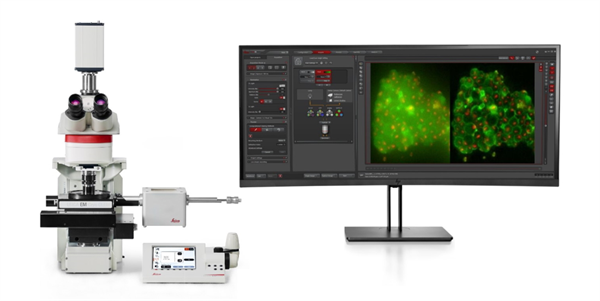
图2:徕卡THUNDER imager EM Cryo CLEM系统。
样本制备
除了显微镜技术,样本制备在视觉观察方面同样扮演者重要作用。科学家希望看到样本的原生状态,或者至少尽可能接近原生状态。化学固定技术可能会改变这种原生状态。因此,活细胞目前仅限于通过光学显微镜研究。对于电子显微镜来说,可以通过对样本进行完全玻璃化冷冻处理来保持这种原生状态。

图3:使用转移舱将载网夹具加载到THUNDER Imager EM Cryo CLEM中。1显示夹具可以携带最多两个载网;2是用于将转移舱对接到冷冻载物台;3是冷冻载物台本身
CLEM解决方案
徕卡显微系统一直在继续改善光学和电子显微镜的组合。这个过程通常称为CLEM(光电关联显微技术)。除了用于EM(电子显微镜)样本制备的成熟工具,如Leica EM GP2载网冷冻仪、Leica EM ICE高压冷冻机、Leica EM VCT真空传输系统,以及结合Leica THUNDER Imager活细胞成像仪和Leica EM ICE高压冷冻机的全新Nano工作流程,可在特定时间点通过玻璃化冻存样本,Leica THUNDER Imager EM CryoCLEM是低温条件下采用CLEM的关键工具。
EM样本制备的丰富经验,加上对于科学显微镜的专业知识,让徕卡显微系统能够以本家单独供应商提供这种解决方案。Leica CryoCLEM解决方案自推出以来已多次登上许多高影响力刊物:
Strnad et al., Sci Rep. 2015 Dec 10;5:18029. doi:10.1038/srep18029.[1]
Schorb et al., J Struct Biol. 2017 Feb;197(2):83-93. doi:10.1016/j.jsb.2016.06.020.[2]
Kolovou et al., Methods Cell Biol. 2017;140:85-103. doi:10.1016/bs.mcb.2017.03.011.[3]
Schorb & Sieckmann, Methods Cell Biol. 2017;140:321-333. doi:10.1016/bs.mcb.2017.03.012.[4]
Yang et al., J Struct Biol. 2021 Feb 18;213(2):107709. doi:10.1016/j.jsb.2021.107709.[5]
Leica Cryo CLEM解决方案的关键是转移舱,它保证了在低温条件下安全转移样本。
THUNDER Imager EM Cryo CLEM - 介质 | 产品 | 徕卡显微系统 (leica-microsystems.com)
转移舱的独特设计可以让我们分离样本传输系统和显微镜载物台。这可以最大限度降低交叉污染。节省时间则是转移舱的另一个优点,因为转移舱可以在荧光成像期间紧接着烘干,或者在成像时,简单地准备第二个转移舱用于样本转移。
荧光成像和FIB切割相互分离具有许多优点。举例来说,荧光成像允许在样品进入冷冻FIB-SEM或Cryo TEM之前进行快速质量检查。这最大限度地利用了FIB-SEM和TEM系统时间,可预先判断样本的适用性。在样本进入EM之前,可以确认目标结构的荧光表达,可以检查载网损坏情况等。由于大多数EM系统都特别定时使用,经过光学显微镜验证的高质量样本可以最大限度提升预约电镜机时内的成果产率。
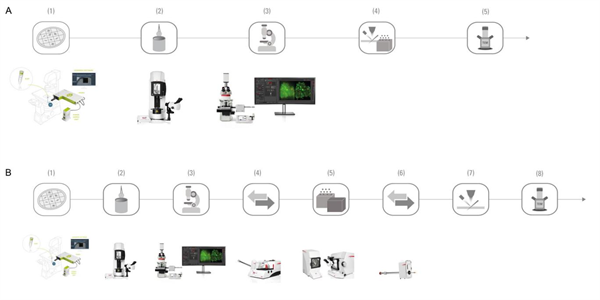
图4:冷冻载网薄片工作流程 – A) 使用Thermo Fisher Aquilos冷冻-FIB SEM.(1)使用PRIMO进行细胞定位 |(2)投入冷冻(EM GP2)|(3)识别感兴趣区域(THUNDER Imager EM Cryo CLEM)|(4)使用Thermo Fisher Aquilos冷冻FIB SEM进行减薄和镀膜 |(5)在TEM中的成像。B)适用于除了Thermo Fisher Aquilos冷冻-FIB SEM以外的所有 FIB-SEM供应商。(1)使用PRIMO进行细胞定位 |(2)投入冷冻(EM GP2)|(3)识别感兴趣区域(THUNDER Imager EM Cryo CLEM)|(4)转移(EM VCM)|(5)镀膜(EM ACE600/EM ACE900)|(6)转移(EM VCT500)|(7)在FIB中减薄|(8)在TEM中成像
解决方案演变
基于宽场荧光显微镜与特殊冷冻台的初始组合,以便样本在冷冻后保持在低温/玻璃化的状况,执行了多项解决方案。这包括徕卡的独有的实时去除非焦面信号技术THUNDER技术,甚至包括LIGHTNING等共焦显微镜,都已经推向市场。此外,科学家还在这一组合的基础上,采用超分辨率技术。Wolff et al., Biol Cell. 2016 Sep;108(9):245-58. doi:10.1111/boc.201600008 [6].Cryo-FIB Lift工作流程同样即将迎来进一步的开发:Klumpe et al., bioRxiv preprint doi: https://doi.org/10.1101/2021.05.19.444745 [7].
实践应用
除了技术发展和突破科学方法带来的兴奋,cryo CLEM还带来了科学洞察。结构生物学显然是cryo CLEM最重要的领域:
Paul et al., J Cell Biol.2020 Sep 7;219(9):e201911154 [8] 发现了细胞骨架形式中意想不到的多功能性,具体来说就是他们通过对这些小分子诱导的样品投影部位进行原位冷冻电子断层扫描 (cryo-ET) 分析发现了微管腔内的丝状肌动蛋白 (F-actin)。在此实验中,冷冻荧光显微镜有助于识别具有新出现的具有目标投影结构的细胞。
Allegretti et al., Nature.2020 Oct;586(7831):796-800 [9] 能够在大分子水平的细胞环境中直接识别核孔复合体(NPC)的结构-功能关系。Cryo CLEM研究有助于确定氮饥饿水平,从而确定发生在NPC的自噬机制募集的时间点。
Li et al., Prog Biophys Mol Biol.2021 Mar;160:87-96 [10] 使用冷冻荧光显微镜识别并标记PC12细胞神经突中的线粒体。荧光标记便于后续冷冻电子断层扫描(cryo ET)的对感兴趣位置的定位导航。
Klein et al., Commun Biol.2021 Jan 29;4(1):137 [11] 研究了层状体 (LB),发现一种未被描述过的外膜圆顶蛋白复合体(OMDP)是LB的限制膜。他们通过结合已标记LB的荧光显微镜、FIB减薄、Cryo ET和反向关联到冷冻荧光显微镜获得的数据,发现LB的生物发生由平行膜片导入和限制膜的曲率驱动,以最大限度提高油脂储存能力.
一般来说,cryo CLEM也是研究宿主-病原体相互作用的有效工作流程方法,尤其是单纯由于病毒大小而导致的病毒感染。此类方案的示例包括:
Strnad et al., Sci Rep. 2015 Dec 10;5:18029. doi:10.1038/srep18029.[1]
Hampton et al., Nat Protoc.2017 Jan;12(1):150-167.[12]
Vancová et al., Front Microbiol.2017 Apr 11;8:596.[13]

图5:坐标变换原理。使用基准点作为支撑点,将靶坐标从光学显微镜转移到FIB-SEM。黄色:校准珠子;红色:Nup159-Atg8-split Venus.左图:共聚焦图像的投影,圆圈标记示例性珠子、箭头标记的目标NUP。中间图像:用相同珠子标记的SEM图像。右图:通过在两种模式中叠加珠子信息创建叠加荧光和SEM图像。因此,目标位置被投射到SEM图像中。比例尺:20 µm.
展望
由于cryo CLEM是一项非常新的技术,在过去一年已发展成为不限于专家使用的研究工具,这将是在未来的科学工作流程中发现未知事物的关键步骤。Leica THUNDER Imager EM Cryo CLEM产品经理Julia König博士总结说:
目前为止,我们已经揭开细胞内部的秘密;接下来我们将在整个组织内部发现什么更有趣的东西呢?
References