免费下载《低温光学显微镜的新成像工具》
LIGHTNING和TauSense如何提高聚焦离子束(FIB)加工的定位精度
LIGHTNING超分辨率检测和TauSense技术能够获得更好的低温荧光成像,促进了低温光电联用工作流程。
荧光显微镜图像能够为cryo-FIB加工提供定位支持,其质量决定了所制备薄片的结果。本文描述了LIGHTNING技术是如何显著提高图像质量,以及如何利用该技术基于荧光寿命的信息来辨别样品的不同结构。
介绍
冷冻电子断层扫描技术(Cryo-ET)是一种透射电子显微镜(TEM)技术,该技术通过分析一系列倾转图像,对相对较薄体积的样品(约200-300nm厚)进行成像。通过该技术,可以揭示蛋白质的3D分子结构。
随着近十年来,cryo-FIB和cryo-TEM的样品制备技术飞速发展,,已经可以实现在细胞内部的天然环境中,使用cryo-ET技术解析蛋白质和其他生物分子的结构,分辨率可达到亚纳米级。使用这种方法,细胞需要生长在TEM载网上,再通过投入冷冻将样品玻璃化,然后转移至冷冻-FIB/SEM加工出小窗口(薄片)。随后就可以使用cryo-TEM对薄片成像,获得一系列倾转图像。细胞的成像窗口必须足够薄,以便允许电子束穿透样品。
然而,为了确定样本中的特定点,需要对感兴趣区域进行高精度地定位。目前,这主要是通过冷冻共聚焦荧光显微镜进行3D高精度成像实现的。共聚焦针孔能够消除了离焦光线,特别是在轴向方向,从而提高分辨率和对比度。
在下文中,解释了如何在低温条件下使用LIGHTNING超分辨技术和TauSense基于荧光寿命的工具,使用荧光显微镜更好地辨别和识别目标结构,以便用于后续的电镜工作流程。
低温条件下的超分辨LIGHTNING技术
该技术是如何工作的?
尽管共聚焦显微镜提供了极好的3D扫描成像质量,但在成像过程中仍然会发生衍射现象,从而限制成像的分辨率。该现象是每个成像系统设置的特征,可以描述为所谓的点扩散函数(PSF)。该方法得到的图像是样本与成像系统的PSF和设定条件的卷积(折叠)。衍射现象会产生较为模糊的图像,导致有效分辨率降低和每一个光子定位偏差。同时,样品图像还存在其他干扰信号,如背景和噪声,影响从原始数据中获得的信息。
然而,现在可以通过精密的模型,从样品的离焦区域识别单个光子的干扰信号,然后通过与其原始位置的相关性对其进行反
卷积。通过这种方法可以获得超分辨率图像。
反卷积是一种较为普適的技术众所周知的,但什么是特别的那LIGHTNING有什么特别的地方?
共聚焦显微镜的传统反卷积方法,通常使用一个全局设置进行图像重建,该过程不考虑图像中的不均匀性。因此,携带信息的信号可能被拒绝,而不需要的信号(如背景或噪声)可能被错误地解释为信息。
另一方面,LIGHTNING技术包括位置依赖、精确体素的差异。这种自适应过程能够全自动、准确地恢复任何生物样本的信息,即使在低温条件下的成像结果(图1)。
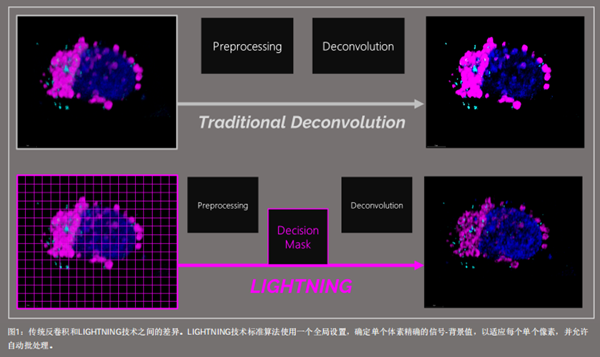
使用STELLARIS Cryo共聚焦显微镜时,LIGHTNING技术如何提高样品定位精度?
通过去除不需要的背景信号和噪声,LIGHTNING技术能够提高图像质量。在实际反卷积之前的预处理步骤中,需要确定全局背景值。根据实际局部信号和噪声之间的比值,将全局背景微调至局部背景值中。噪声可以根据其高空间频率进行识别,通过忽略噪声可以更好地获得携带有信息的信号。
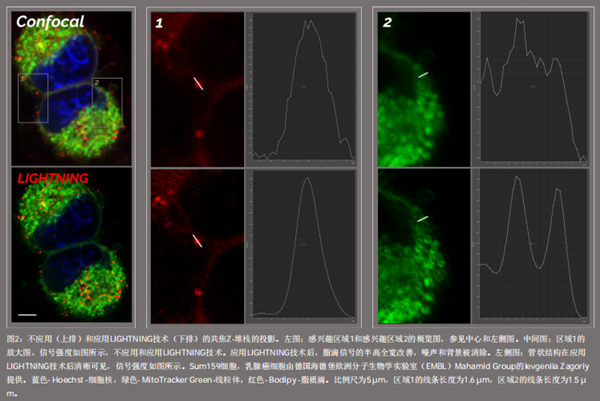
图2为使用标准共聚焦显微镜(上图)和LIGHTNING超分辨共聚焦(下图)拍摄的两个代表性的癌细胞图像,其中显示了线粒体(绿色)、脂滴(红色)和细胞核(蓝色)。从对比结果中可以清楚地看到,LIGHTNING技术能够去除背景和噪声,获得对比度较高的图像,更容易识别和辨别目标结构。图像质量的明显改善,使得识别后续相关步骤所需的目标结构变得更为容易。
当在高倍镜下成像时,LIGHTNING技术的影响更加明显,如图2所示的放大区域。
如区域1中的脂滴图像所示,通过LIGHTNING技术能够降低背景和噪声,从而改善信号,更精确地定向观察脂滴结构。
在区域2中所观察到的管状结构也得到相同的结果。LIGHTNING技术提高了线粒体膜的对比度,使管状外观更加清晰,不仅提高了定位效率,而且增强了CLEM光电关联过程的精确度。
使用LIGHTNING技术反卷积后,我可以量化我的数据吗?
答案是肯定的。生成决策掩码的过程基于通用图像处理方法,因此是完全可量化的。整个流程中,没有改变单个光子的强度或定位特征,以及光子计数信息。该流程仅从现有共聚焦数据中提取信息,不做任何修改。
无论是否使用自适应方法,在重建过程中没有局部和相对强度失真。通过使用自适应的、基于决策掩模的方法,将产生伪影或丢失信息的概率降至最低。