冷发光基础原理
自然界中有许多发光过程。冷发光是一系列发光现象的统称,是指不因高温而引发的发光事件。本文描述了不同形式的冷光并对荧光进行了详细介绍。在第二部分解释了描述荧光色素的相关技术术语,如淬灭、漂白或量子效率,以便对荧光分子的基础特性有更深入的了解。
发光过程
一些非常常见的生物学或生化实验室方法的命名都建立在几个“…escences”(光)的基础之上,如磷光、化学发光、生物发光还有荧光。考虑到本文为荧光蛋白的主题介绍,因此了解更多关于“…escences”的知识会相当实用。这些现象的命名起源于拉丁语单词:- escentia,这就已经暗示了该现象与我们视觉系统有关联。所有“…escences”都阐述了我们用眼睛可以感知的物理、化学或生物学过程。我们在表示变化、行动或过程的单词当中加上后缀“…escence”就是为了突出这一点,例如“convalescence”(即眼睛可见的康复过程)一词。
所以很明显,荧光是指我们能够看到并且与某种变化或过程有关的现象。我们在下文将了解到荧光如何满足这些条件。首先,我们要简单看一下其他带“…escences”的单词,这些词本身就表示冷发光现象。冷发光其实是非高温作用下依然存在的发光现象的总称。因此,冷发光可认定为冷体辐射的一种表现。这种辐射既可以是化学反应的一部分,也可以是引起晶体亚原子运动或应力的成因。另一种产生光辐射的方式是白炽,即物质因热(如高温金属)而发光。
化学发光是一种基于化学反应的发光过程,其产物中含有激发中间物。这种中间物在进入基态时会发光。与荧光不同,化学发光材料中的电子由化学反应激发产生而不是光子吸收所产生。例如,荧光棒的技术应用就是化学发光。比较出名的一种化学发光物质是鲁米诺(发光氨),主要在刑事犯罪中用来寻找血迹。在该应用中存在于血红蛋白内的Fe2+离子会作为催化剂将鲁米诺带到发光结构中。
如果某个生物体能发光,不论这种光是如何产生的,我们都称之为生物发光。很多生物都能产生光,比如欧洲萤(Lampyris noctiluca)或北美萤火虫(Photinus pyralis)。在其他几种真菌中,有一种非常特别的微生物叫杰克灯蘑菇(Ophalotus nidiformis(奥尔类脐菇),幽灵蘑菇)可在黑暗中发光。许多海洋生物如一些珊瑚、藻类、甲壳纲动物甚至鱿鱼也可以发光,发出的光几乎均为蓝色或绿色光谱。另一种可发出生物光的海洋生物是维多利亚多管发光水母,也是绿色荧光蛋白(GFP)的来源。不过萤火虫只能利用化学发光过程来产生光,而维多利亚多管发光水母则同时利用了化学发光和荧光过程。科学家们发现,这种水母凭借水母发光蛋白质通过化学反应产生蓝光,然后在荧光反应中利用蓝光来激发上文提到的GFP,从而产生绿色荧光。
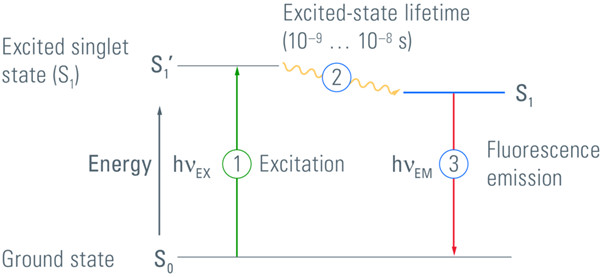
图1:荧光Jablonski图
这就让我们不由得提出这样的问题:“什么是荧光?”荧光是指物质在吸收了较短波长的光线之后发射出长波长光的一个过程。这种波长上的差异又称为斯托克位移。具体来说,如果物质吸收了光子形式的光就会产生荧光。这会导致电子位移到更高的能级。但这种高能情况非常不稳定,这就是为什么电子往往会回到基态。在这个过程中,能量再次以光子的形式释放出来,可以看作是一种辉光。与磷光相反,电子能量转移非常快,常常在纳秒的级别(图1)。任何能够在另一种明显不同的波长激发之下发射光的物质就称为荧光素。这些物质在后续章节中予以讨论。自然界中绝大多数发出荧光的物质都存在较宽的激发和发射光谱,但已明确的激发和发射波长的物质在荧光显微镜中的实用性更强。
和荧光类似,磷光是一种磷光材料受到光激发后的发光现象。尽管磷光与荧光密切相关,但磷光的发光速度要慢得多。与荧光相反,电子能量与“禁止”状态结合会让光子的再发射减慢。由于能量被“困住”,所以磷光返回基态的速度不如荧光。磷光材料的典型例子就是“黑暗中发光”玩具,它可以用普通灯泡或日光“充电”然后发光几分钟甚至几个小时。
荧光素
上文提到过,荧光素是指任何能够发出荧光的物质。荧光蛋白就是一种荧光素。在详细讲解之前,我们应当先介绍荧光蛋白的几个术语和表述。与荧光相关且比较常用的词是荧光团:荧光团是分子(如蛋白质)中负责产生荧光的部分。因此,GFP或其衍生物是与GFP或其衍生物(如α-微管蛋白-GFP)相连的任何杂交蛋白的荧光团。但荧光团不一定是蛋白质。诸如FITC、TRITC(20个原子)或量子点(100-100000个原子)等小分子也是荧光团。
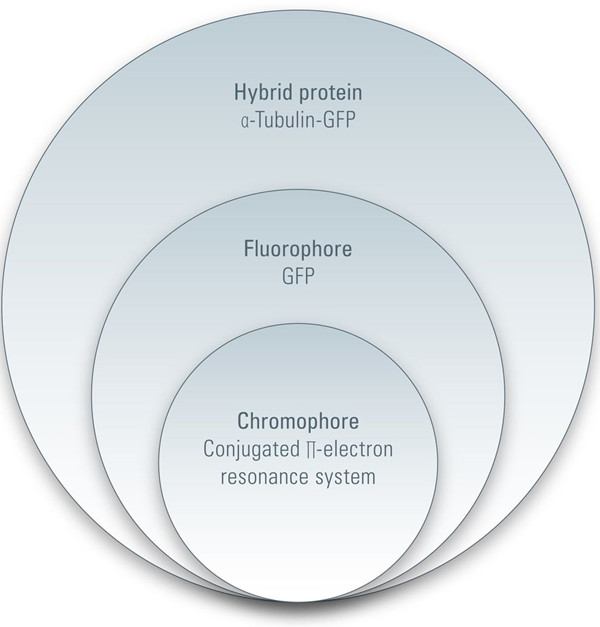
图2:荧光蛋白等级
再稍微深入一点,我们就可以看到发色团,即分子当中决定其颜色的部分(见图2)。在发色团内部会发生电子的能级转换和相互关联的光发射(见上文)。发色团至少有两种形式,要么由共轭π-电子共振系统(如GFP)构成,要么由金属配合物(如叶绿素、血红素)构成。
鉴于荧光与显微镜的相关性,我们要再深入一点了解GFP的发色团。 研究发现,对于GFP发色团的形成,除了分子氧之外,其他辅助因子或酶成分完全不是必要的。由GFP氨基酸骨架的一级结构决定,它以自催化折叠机制自发形成,并通过分子内重排完成。具体来说,发色团由三种相关的氨基酸组成:Ser65、Tyr66和Gly67依次经历环化、脱水和氧化,反应后最终得到共轭π-电子共振系统,即成熟的GFP发色团。
再从整个GFP结构看,环状三肽位于一个圆柱的中间。这个圆柱由11条链组成并形成β-桶状结构,为蛋白质带来了较高的稳定性。β-桶状结构的直径约为3nm,高度约为4nm(见图3)。目前已知的所有FP都有这种保护性圆柱,这对它们的光物理性质有很大的影响。在GFP情况下,量子效率和光稳定性相对较高。此外,十分紧凑的蛋白质结构会带来较高的pH耐性。带有GFP标签的样本受温度影响较小,对变性物质如多聚甲醛、尿素或盐酸胍有很高的耐受性。
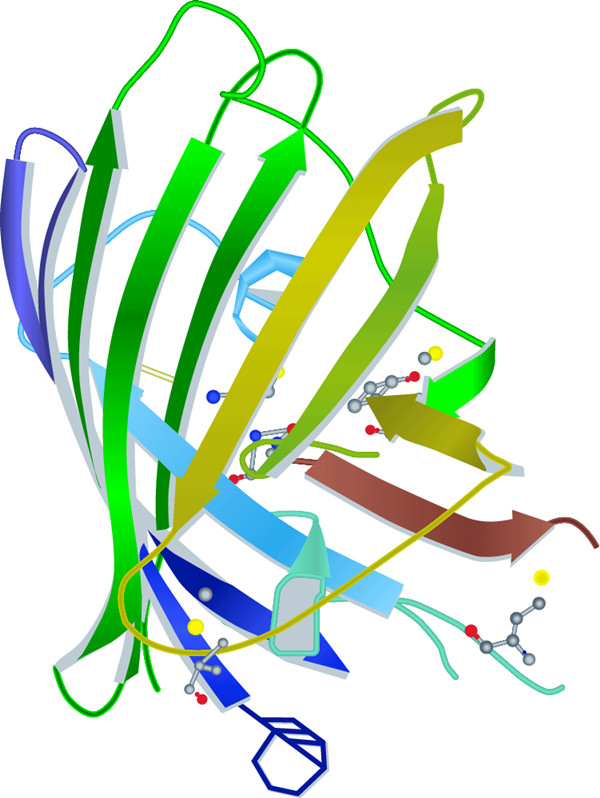
图3:绿色荧光蛋白(GFP)的分子结构
淬灭和漂白
即便如此,FP也面临着一定的限制和局限性,这方面内容会在接下来的章节中提及。例如,淬灭过程以逆向方式减弱荧光团的强度。这种衰减的原因较为多样。一方面可能存在复合体的形成或内部的转换。另一方面,淬灭也可能是能量传递过程中的一种作用效应。称为FRET的显微镜应用正是充分利用了这一过程。在Förster共振能传递或荧光共振能量传递过程中,供体荧光团D会传递到受体荧光团A上面。D的荧光会减弱而A的荧光会增加。
与淬灭这种可逆过程不同的是另一种称为漂白的不可逆荧光减弱过程。永久性荧光损失是由于长时间的激发光曝光而导致荧光团被破坏。漂白量取决于光源的强度、曝光时间和能量。每个荧光团在漂白前都有一定量的激发和发射循环。例如GFP,每个分子可以激发大约104-105次。
使用共聚焦激光扫描显微镜时,光强度通常在106 W/m2左右。这种高能量剂量会传递过量的光子而导致出现许多荧光分子都处于激发状态的现象。这种情况下分子不再以通常的波长吸收光。所以,有效染料浓度就会降低,或者换言之,显示器上所描绘的像素不再是染料浓度的直接函数。与单纯弧光灯照明相比,使用高能量激光会导致发射和激发之间形成非线性关系。
量子效率
提到荧光蛋白的效率,我们应当先提一提量子效率这一概念。这是荧光团当中比较光子输入和输出的另一特征。在计算特定荧光团的量子效率时需要用发射出的光子除以吸收的光子:
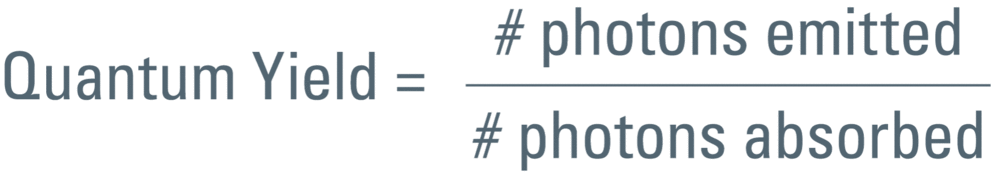
所以在100%的产出之下,量子效率为1。用于激发的每一个光子在发射当中会产生1个光子。但这只是理论值。实际当中用于激发的光子数量远比获得的发射光要多。例如,GFP的量子效率为0.6(见表1)。换言之,要获得6个光子的发射就必须使用10个光子进行激发。
亮度
荧光蛋白的亮度则是运用荧光显微镜时需要考虑的另一项重要特征。该参数是实验获得成功的关键点之一。指定荧光蛋白亮度的客观方法之一是将摩尔消光系数乘以其量子效率再除以1,000。物质的摩尔消光系数能够让我们了解物质在某个明确波长下的光吸收情况。具体来说,摩尔消光系数是指单位摩尔浓度的物质在1cm距离处的特定波长下吸收电磁辐射的度量指标。因此对应的单位为M-1 cm-1。
在该计算的帮助下就可以比较不同荧光蛋白的亮度。如果我们以摩尔消光系数为56,000 M-1 cm-1 且量子产额为0.6的EGFP作为举例,则我们会得出33.6 M-1 cm-1的数值。有时人们也会提到荧光蛋白的相对亮度。在这种情况下亮度计算需要将摩尔消光系数乘以量子效率再除以EGFP的亮度值(33.6 M-1 cm-1)。

在该计算的帮助下就可以比较不同荧光蛋白的亮度。如果我们以摩尔消光系数为56,000 M-1 cm-1 且量子产额为0.6的EGFP作为举例,则我们会得出33.6 M-1 cm-1的数值。有时人们也会提到荧光蛋白的相对亮度。在这种情况下亮度计算需要将摩尔消光系数乘以量子效率再除以EGFP的亮度值(33.6 M-1 cm-1)。
光稳定性
许多荧光显微镜实验都主要针对活细胞的观察。考虑到淬灭和漂白等特性,显然活细胞成像高度依赖于时间。即使是在组织学或固定细胞样本的情况下仍必须注意不要照射样本太长时间,而且也不要采用太高的光强度。对于感兴趣的荧光蛋白,光稳定性这一参数能够描述其抵御自身荧光性能下降机制的能力。光稳定性用50%的初始亮度消失所经过的秒数来表示。为便于比较,需采用最大10 W/cm2的弧光灯提供照明,而高强度光源如激光器等(高达100 W/cm2)可能会产生非线性效应。此外,为了测量并比较光稳定性,需将荧光蛋白样本的pH值标准化至7.0,并且蛋白质溶液的液滴需适应典型哺乳动物细胞的大小。上述光源为连续照明。同时对光子的发射进行计算。EGFP原始亮度减退一半需要174秒(Shaner等人2005)。换言之,发射从1,000光子/秒下降到500光子/秒需要174秒。
通过了解某种荧光染料或蛋白质的不同特性,如激发和发射最大值、亮度、量子效率等,实验人员就可以选择不同的候选条件或观察条件来满足他对某个特定实验设置的要求。此外,如果实验人员清楚知道不同荧光染料或蛋白质的光物理特性,就能够很详细地判读实验结果了。
阅读更多有关荧光蛋白、光谱特征及其应用的文章
Fluorescent Proteins – Introduction and Photo Spectral Characteristics
Modern Fluorescent Proteins and their Biological Applications
Fluorescent Proteins – From the Beginnings to the Nobel Prize
参考文献
Shaner NC, Steinbach PA, Tsien RY. A guide to choosing fluorescent proteins. Nat Methods 2:12 (2005) 905–9.
Header photo: © by David Mülheims, Germany