使用光片显微镜进行人类早期大脑类器官发育的形态动力学研究
脑类器官使得人类大脑发育的机制研究成为可能,并提供了在不受限制的发育系统中探索自我组织形成的机会,类器官的成像观察是理解其微观结构和功能的重要手段(文献1)。由于人脑类器官的尺寸较大,组织致密,发育缓慢,且在几周到几个月的发育过程中需要无菌成像条件,使得对人脑类器官的活体成像特别是长时间,面临巨大挑战。
在本例中,作者建立了长期的活体光片显微镜技术,应用于由荧光标记的人类诱导多能干细胞生成的无指导脑类器官,这使得我们能够在类器官发育的数周内跟踪组织形态、细胞行为和亚细胞特征,为研究人类大脑形态动力学提供了新的途径,并支持基质相关的机械感知动态在大脑区域化过程中发挥核心作用的观点。
稀疏和多位点荧光标记脑类器官的长期活体成像
01类器官的培养
本研究中使用的细胞系为:
Histone2B-mEGFP 均匀标记细胞核
mEGFP-Beta-Actin 均匀标记 ACTB
mTagRFP–T–CAAX 标记细胞膜
mTagRFP–T-LaminB1 标记 LMNB1
未标记的 WTC iPSCs
操作流程:
干细胞系按标准流程培养和传代
96孔板,每孔加入500个细胞/3000个细胞,在 mTSR+中(加入1:200 ROCKi和1:200Pen-strep),并以 200g离心5分钟以生成胚体(EBs)
在第 2 天更换新鲜的 mTSR+,加入1:200 ROCKi 和 1:200 Pen-strep
第 4 天提供含 2%溶解的 matrigel 的新鲜神经诱导培养基,并每隔一天更换一次
第 10 天提供含 2% matrigel 的分化培养基-VitA,并在第 15 天提供含 1% matrigel 的分化培养基+ VitA
第 15 天将类器官转移到 24 孔板中,每孔一个类器官,并转移到摇床上,随后在一个月时将每孔一个类器官转移到 6 孔板中,并保持在摇床上
嵌入基质胶中,并培养在样本室微孔中的细胞球用于光片成像
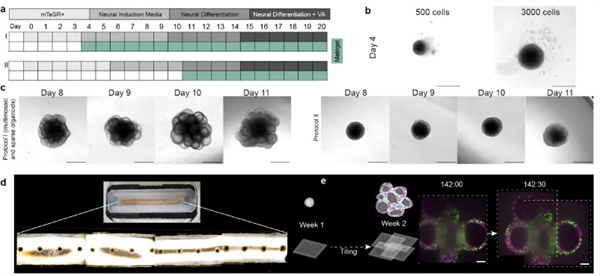
图1.脑类器官培养 a)本研究开发的流程示意图(流程I)和之前的多区域人脑类器官(流程II)b)在两种细胞接种浓度下,聚集后第4天类器官大小的比较,比例尺为500μm c)显示在两种不同的流程下,第8-11天类器官生长的名称图像 d)样品保持室的照片,包含四个分隔的子室,每个子室有四个微孔,用于生长和成像16个不用的类器官,每个微孔一个。
02长期活体成像观察
胚胎体(4 个)嵌入溶解在神经诱导培养基中的 20-50%基质胶中或覆盖在 0.6%的低熔点琼脂糖上。
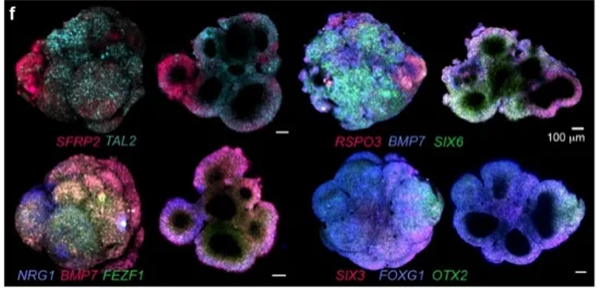
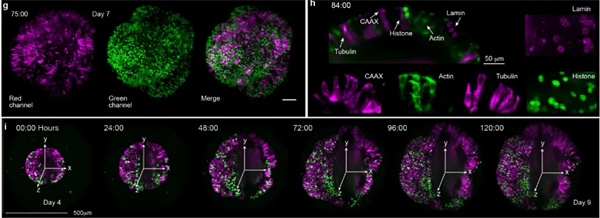
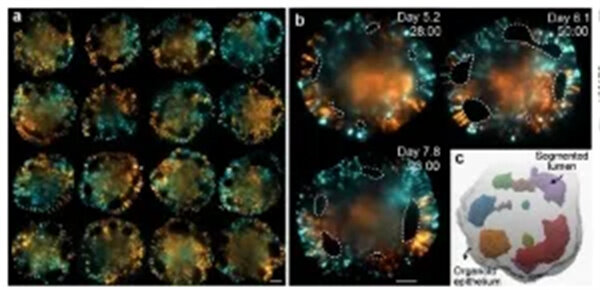
图2.稀疏和多位点荧光标记脑类器官的长期活体成像.f、4 个不同类器官(第 15 天)的 3D 投影(左)和横截面(右),用全切片荧光原位杂交链反应(HCR)染色标记转录本。比例,100 微米。g) 从 188 小时成像实验中 75 小时成像的最大投影图像。类器官包含 5 种不同的细胞系,这些细胞系具有稳定的蛋白质遗传标记,使用红色或绿色荧光蛋白(RFP,GFP),以及未标记的细胞。比例,100 微米。h) 组织器切片(84 小时)显示核膜(Lamin,RFP,品红色)、质膜标记(CAAX,RFP,品红色)、肌动蛋白(GFP,绿色)、微管蛋白(RFP,品红色)和细胞核(组蛋白,GFP,绿色)。i) 不同时间点的图像显示最大强度投影(左半部分)和切片(右半部分)。
每两天更换一次培养基。成像使用 Viventis LS1 Live 光片显微镜进行,具体设置如下:
物镜——25X NA1.1水镜
成像视野——710μm
xy 像素大小——0.347μm
Z轴步径——2μm,201 步
采集帧率为——30 分钟
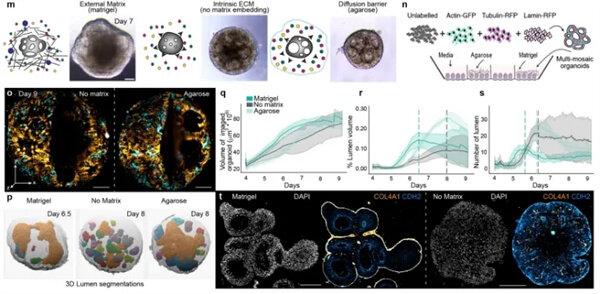
外源性细胞外基质影响大脑类
器官的形态发生
外源性细胞外基质影响大脑类器官的形态发生
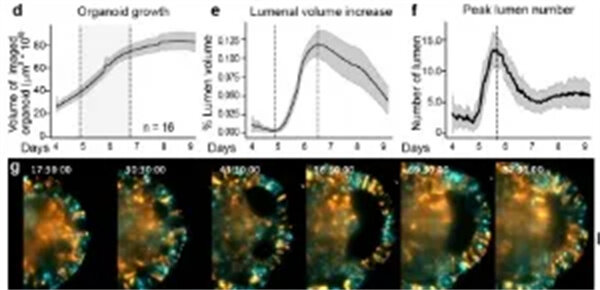
为了量化类器官之间的形态动态变化,作者利Viventis LS2光片显微镜低光毒性、多位点、多视角的成像能力,一次成像并行记录16个类器官通过统计分析不同时间点类器官体积、腔室体积和腔室数量,结果突出了早期大脑类器官发育的三个形态动力学阶段,包括:
快速组织和腔体生长的早期阶段
涉及腔体融合事件的组织稳定阶段
神经上皮成熟的最终阶段
对比用基质胶、低熔点琼脂糖和不使用任何外源基质培养类器官,使用光片长时间跟踪类器官动力学,结果显示外源细胞外基质的存在对人脑类器官的组织尺度形态发生有重大影响,且改变的组织极性可能会影响成熟神经上皮中的细胞形态动力学。
图3.外源性细胞外基质对大脑类器官形态发生的影响。a) 类器官投影(第 7 天)显示 16 个同时图像采集,展示核膜(Lamin,RFP,橙色)、质膜标记(CAAX,RFP,橙色)、肌动蛋白(GFP,青色)、微管蛋白(RFP,橙色)和细胞核(组蛋白,GFP,青色)。最大投影(左)和横截面(右)b) 来自同一类器官在不同时间点的静态图,显示横截面并突出腔体形态(虚线)c) 类器官的横截面显示分段腔体和类器官上皮分割图。d) 第 4-9 天每天测量的类器官总体积e) 图表显示随时间变化的所有腔体的总体积f) 图表显示随时间变化的分段腔体总数的变化。g) 类器官的横截面显示腔体形成和融合的过程m) 细胞外微环境的示意图及与之对应的明场图像,显示用 Matrigel(外部 ECM)培养的类器官、没有任何外部嵌入(内部 ECM)和低熔点琼脂嵌入(扩散屏障)。n) 示意图显示光片实验设置,以获取不同嵌入处理的 16 倍类器官的同步成像。o) 第 9 天的图像静帧,显示没有任何嵌入和带有琼脂扩散屏障的类器官的最大投影(左)和横截面(右)。p) 用 Matrigel 培养的类器官、没有基质和带有扩散屏障的类器官中分段腔的 3D 渲染。q-r) 图表显示从第 4 天到第 9 天每天测量的所有成像类器官的总体积(q)、分段腔的总数变化(r)以及所有腔的总容量随时间的变化(s)误差条表示标准差。t) 图像显示了在使用基质胶或无基质生长的类器官(第 15 天)上进行免疫组化实验的横截面,并染色以显示细胞核(DAPI)、COL4A1 和 CDH2。所有图像的比例尺为 100 μm。
单细胞形态类型分析揭示了发育中的类器官内形状的转变
研究人员利用多位点标记的质膜、肌动蛋白、微管、核膜和组蛋白评估细胞形态变化在早期大脑类器官发育过程中对细胞的影响。通过开发的图像分析流程:图像预处理→亚细胞结构分割→结构预测→特征提取→解多通道→形态特征分析,揭示了两个主要的核(组蛋白、层粘连蛋白)和细胞(肌动蛋白、微管、膜)结构组。
通过高分辨率聚类,将结构分组为形态类型,即具有相似形态特征(如体积、曲率、轴长的细胞簇,使用PAGA轨迹分析识别组织中的结构变化梯度,量化了多能干细胞向早期神经外胚层的过渡,基于细胞结构形态和组织拓扑变化形成成熟的神经上皮。
通过对每种基质条件(基质胶、琼脂糖和无外源基质)下,对每一天成像的类器官进行标记结构的分割以及形态学分类分析,结果表明在没有基质胶作为外部细胞外基质的情况下生成的类器官在组织拓扑上发生了变化,包含更大比例的非排列和非延长细胞,细胞形态类型的异质性更高,并且未形成均匀的神经外胚层和神经上皮。
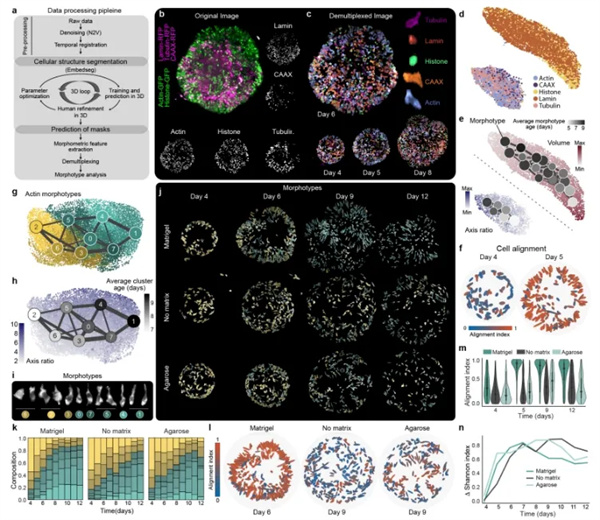
图4. 使用接多路多位点细胞标签的细胞和细胞核形态转变。a)分析策略示意图。b) 第 6 天的类器官最大强度投影,标记有核膜(Lamin,RFP,粉色)、质膜(CAAX,RFP,粉色)、肌动蛋白(GFP,绿色)、微管蛋白(RFP,粉色)和细胞核(组蛋白,GFP,绿色)c) 解通道图像(Lamin,深棕色;CAAX,橙色;肌动蛋白,蓝色;微管蛋白,品红色;组蛋白,绿色) d) 基于形态特征提取的所有解多通道标签的 PAGA 初始化 UMAP 嵌入。e) PAGA 初始化 UMAP 嵌入显示肌动蛋白、微管蛋白和 CAAX 标签的轴长变化,以及使用组蛋白和 Lamin 分割测量的细胞核体积变化。PAGA 图显示平均簇年龄(天数)的变化,节点大小表示一个簇内的细胞数量,边宽反映两个簇之间的连接强度。f) 在 matrigel 条件下,所有细胞(肌动蛋白)按其对齐指数(与最近的类器官表面法线的绝对余弦角)着色。比例范围为 0-1,其中 1(红色)对应于与类器官表面垂直对齐的细胞。g) PAGA 初始化的 UMAP 嵌入和 PAGA 图显示使用从基质胶、无基质和琼脂糖条件下分割的细胞的细胞形态类型聚类。图基于提取的所有分割细胞(肌动蛋白)的形态测量。h) PAGA 初始化的 UMAP 嵌入显示细胞轴比随时间变化,并叠加显示使用 PAGA 图的平均聚类年龄。PAGA 图根据聚类的平均年龄从浅灰色到黑色进行颜色编码。i) 每个形态类型聚类的示例细胞(肌动蛋白)。j) 显示标记有肌动蛋白的细胞的类器官示例图像,显示按其形态类型聚类着色的细胞。k) 堆叠条形图显示在基质胶、无基质和琼脂糖条件下各个肌动蛋白形态类型聚类中细胞的比例。l) 图像显示在第 6 天基质胶条件下的细胞(肌动蛋白)根据细胞对齐指数着色,以及在第 9 天无基质和琼脂糖条件下的细胞。m) 小提琴图显示在第 4 天到第 12 天所有三种条件下所有分割细胞的细胞对齐(肌动蛋白)值。n) 线图显示在三种条件下香农指数的变化,基于随时间变化的每个簇的细胞数量(基质胶 (n=3)、无基质 (n=3) 和琼脂糖 (n=3))。
矩阵通过调节 WNT 通路影响类器官的形态发生和模式形成
为了理解在不同基质条件(基质胶、琼脂糖、无矩阵)下生长的类器官中发展出的分子细胞状态,我们对第 13 天的类器官进行了单细胞转录组分析,差异表达基因的基因本体分析显示出多个信号通路的富集,包括WNT、Notch、FGF 和 Hippo 信号通路以及与肌动蛋白细胞骨架调节相关的基因。
基质胶诱导的神经外胚层的强烈形态变化,以及在无基质条件下 WNT 和 Hippo 信号通路的上调,测试了YAP调节对类器官发育的影响。综合证实了我们应用含有外部基底膜丰富的 ECM 的 matrigel,导致腔体扩张并自我模式化为主要的头侧前脑区域,并且 YAP1 的激活和 WLS 表达水平的增加促进了发育中的神经上皮的尾部化。
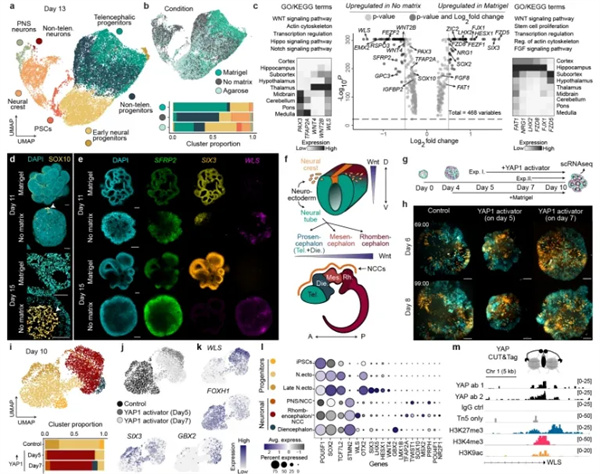
在对人类早期脑类器官的形态动力学研究中,Viventis LS2 Live光片显微镜以极低的光毒性,通过多视角、多位置、长时程的活细胞成像,展现脑类器官的整个发育过程。在单次长时程成像过程中,同时收集多个样本在不同条件下的数据,结合自我开发的分析流程、单细胞转录组分析、信号通路探索分析,展示了YAP1 在基质介导的形态发生和类器官模式化中发挥的作用。
总的来说,这一应用案例为理解类器官发育的形态动力学提供了技术进步,提供了对基质介导的神经上皮信号通路的机制性见解,并为未来探索人类大脑发育过程中细胞外微环境铺平了道路。
参考文献:
1.Method of the Year 2017: Organoids. (2018). Nature Methods
2.Elke Gabriel et.al Human brain organoids assemble functionally integrated bilateral optic vesicles Cell Stem Cell 28, 1740–1757, October 7, 2021
3.Akanksha Jain et.al Morphodynamics of human early brain organoid development bioRxiv | August 21, 2023