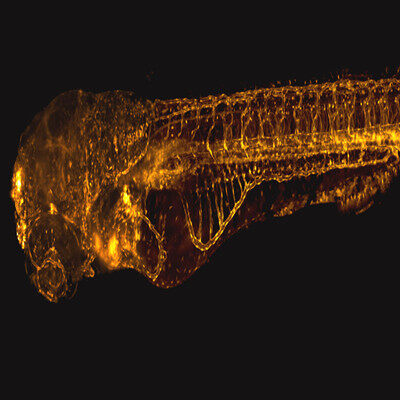
相分离与显微成像
相分离/相变
(Phase separation,Phase Transition)
相分离/相变是近几年生化、细胞生物学新兴且十分火热的研究领域。Hyman和Brangwynne 2009年在Science发表了题为:Germline P granules are liquid droplets that localize by controlled dissolution/condensation 的文章,提出了细胞内通过“相分离”,可以提供一种特定的方式让细胞内的特定分子聚集起来,从而在“混乱的”细胞内部形成一定“秩序”,为困扰了大家多年的问题,提供了全新的思路。
分离或相变(Phase separation,Phase transition)描述的是细胞里不同成分间相互碰撞、融合形成液滴,从而使一些成分被包裹在液滴内、一些成分被阻隔在液滴外的现象,就如同水油相混,细胞里的不同成分也会相互分离,形成液滴,这就是相分离。后续的大量研究也让生物学家发现相分离在细胞生物学中无处不在。2011年,Hyman, Mitchison 和 Brangwynne又发现核仁有液滴现象,后续研究相继发现RNA和蛋白质分子间存在较弱的作用力,形成液滴类的物质、蛋白质-蛋白质存在相分离现象;至2018年CNS上已发表十几篇重要级文章证实相分离的广泛存在和重要性。

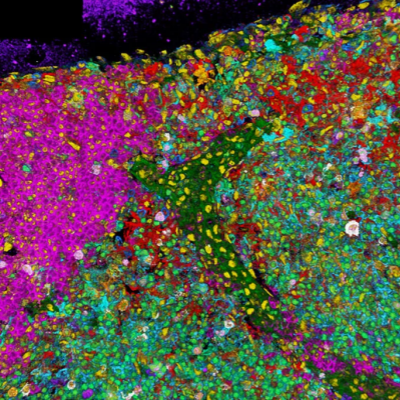
图1. 细胞内的油滴艺术
细胞内的相分离
细胞中存在各种无膜结构的细胞器:颗粒、核仁、Cajal bodies、stress granules、miRISC及突触的细胞骨架等,相分离广泛发生于各种成分之间。
蛋白质或RNA分子
蛋白质或RNA分子间的物理作用力可以使它们相互分开或聚集。一旦分子达到一定浓度,它们就会发生相分离,相似的成分聚集在一起加速生物学反应(类似于相似相容),或者隔离无关的分子。
细胞膜上的信号传递
在神经细胞中,细胞间进行信号传递时,蛋白质在连接处的聚集和相分离是保证细胞间信号传递正常进行所必需的。
DNA折叠包装
在细胞核中,相分离帮助压缩折叠不使用的DNA并抑制其活性。一些可能与转录相关的蛋白被阻隔在外。
液滴成为障碍
在肌萎缩性脊髓侧索硬化症中,分离成液滴的蛋白质会逐渐凝结、变硬,形成有害的固体物质。
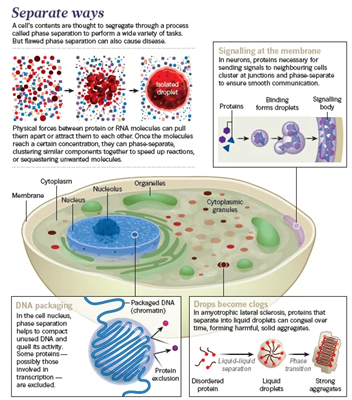
图2. 细胞内的相分离
相分离的主要应用
随着相分离的研究逐渐增多,研究人员发现相分离在无膜器官的形成、信号转导、细胞骨架、超分子组装、基因激活等方面起着重要作用,相分离异常可能导致如神经退行性疾病、肿瘤、衰老等。
神经退行性疾病
在肌萎缩侧索硬化(ALS) (一种运动神经元疾病) 中观察到“相分离”,发现FUS蛋白和hnRNPA1在ALS中形成液滴,液滴粘性逐渐变强,最终形成纤维状的固体,在ALS中异常沉积。
阿尔茨海默病患者脑内异常沉积的tau蛋白也存在相分离,相分离可能是tau蛋白聚集的初始触发因素。
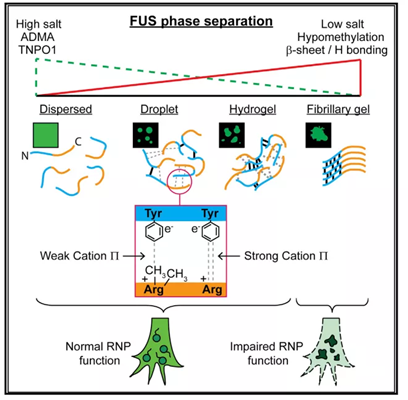
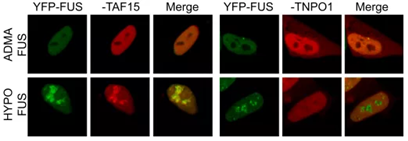
图3. FUS蛋白相分离作用图解;FUS蛋白相分离荧光图像
肿瘤
分子病理学家Miguel Rivera和他的团队发现了一种与尤文氏肉瘤有关的蛋白。这种蛋白聚集在与肿瘤发生相关的基因组附近时可激活致癌基因表达,而异常的相分离就可能促使这种蛋白在这些区域附近聚集。
细胞保护作用
Hyman和Alberti发现酵母细胞在低pH的压力环境下,一些重要蛋白会聚集成液滴启动保护机制。当pH回升后,这些液滴会分散开,细胞恢复正常的功能。
相分离研究中使用的主要技术
研究相分离涉及的相关步骤及技术有很多,首先通常会用到体外重构相分离,通过将目标物质表达纯化,在体外重构相分离的过程,证明存在相分离机制。其次,相分离研究的关键是要证明所研究的目标物质(蛋白、RNA等)存在动态可逆的聚集-解聚状态变化,并且这一变化与目标物质的功能有关。因此如何证明这种动态变化状态是关键。
这一过程包括观察相分离的技术以及影响和调控相分离过程的技术,如:显微成像技术、光调控系统(OptoDroplets、CasDrop)、溶液浑浊度检测、离心沉淀法、表面张力测定(反毛细管速度+被动微流变学)、液滴内部硬度测定(原子力显微镜或光镊)、聚合物网格孔径测定(荧光标记右旋糖苷)等。
显微成像作为观察相分离的主要技术,在相分离中发挥着不可或缺的作用。按观察方式主要涉及明场光学金相显微镜和荧光显微镜。明场显微镜中主要通过微分干涉(DIC)、相差(PH)、偏光(POL)等方法观察体外、无标记的相分离溶液,可获得液滴形成过程、大小及随时间变化、液滴内部纤维性或固态样结构各项异性等结果。对于体外和体内荧光标记的研究对象,则采用荧光显微镜去观察并获取高分辨的液滴形成过程、大小及随时间变化的荧光图像,以及分子扩散性和液滴内部分子扩散能力等研究。
明场显微镜
运用明场显微镜DIC或者PH的功能,可以获得:
液-液相分离形成的液滴,得到形成时间、轮廓大小、融合或裂变扩散等信息;
- 随着加入药物处理,可观察液滴大小变化、融合或者裂变扩散。
如图4,在DIC明场显微镜模式下观察随时间变化,液滴形态大小的变化。

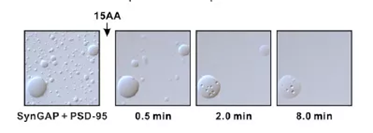
图4. DIC明场显微镜观察相分离随时间的变化过程
荧光显微镜
因其分辨率高,能够清晰观察静态液滴轮廓边界以及亚细胞的分子结构(如图5),对于动态过程的采集,也能获取更为清晰的图像,是相分离成像的主要观察手段。
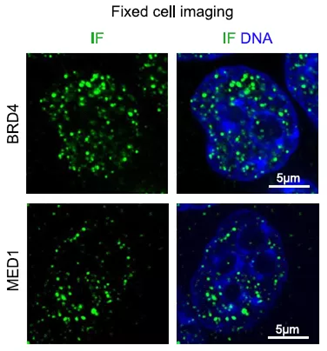
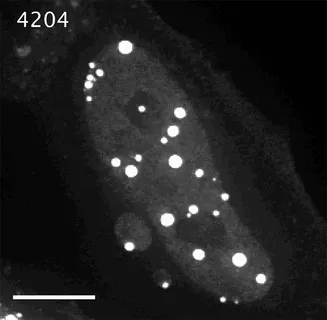
图6. HeLa细胞核中蛋白聚集、分离形成小液滴
激光共聚焦显微镜
除了上述检测液滴轮廓、大小,融合裂变、分子结构、定位等实验外,在激光扫描共聚焦显微镜上还可以进一步利用荧光漂白后恢复实验(FRAP)检测液滴中的扩散行为。FRAP实验原理是使用高强度激光将对选定区域进行漂白,然后观测该区域荧光强度随时间恢复的动力学过程。FRAP是非常有效的研究分子动力学变化的技术手段,它可检测体外和体内的相分离、可评估液滴内部的同质性,具备激光功率可控、灵活照明控制、灵活选择漂白区域等独特优势,在相分离研究中能发挥重要作用。基于共聚焦显微镜的FRAP实验除了可以获取高分辨图像,还能获取动态的漂白恢复曲线信息(如图7),更好地评估相分离中的动力学过程。
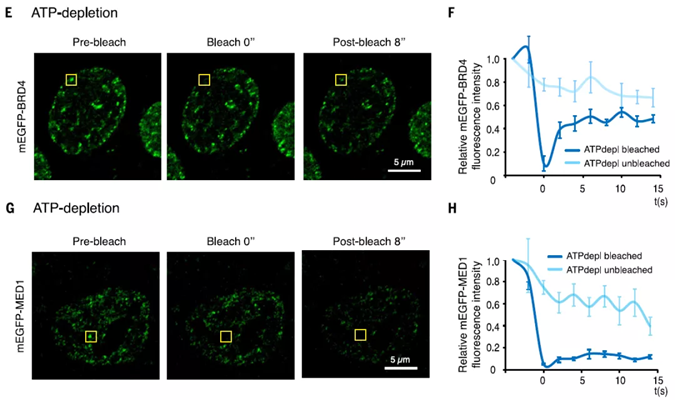
图7. 基于激光共聚焦显微镜的FRAP实验研究相分离
如需观察更为微观的纳米结构,可以使用超高分辨共聚焦显微镜,实现50nm的解析精度,也可使用电子显微镜做进一步的结构分析。
参考文献:
1.Nature|doi:10.1038/d41586-018-03070-2
2.Sabari et al. Coactivator condensation at super-enhancers links phase separation and gene control. Science 2018
3.Qamar et al. FUS Phase Separation Is Modulated by a Molecular Chaperone and Methylation of Arginine Cation-p Interactions. Cell 2018
4.Boulay et.al. Cancer-Specific Retargeting of BAF Complexes by a Prion-like Domain. Cell 2017
5.Zeng et al. Phase Transition in Postsynaptic Densities Underlies
Formation of Synaptic Complexes and Synaptic Plasticity. Cell 2016
6.Simon Alberti, et al. Considerations and Challenges in Studying Liquid-Liquid Phase Separation and Biomolecular Condensates. Cell 2019