从多能干细胞(PSC)培养类器官
在体外建立起可以准确而完整模拟各种体内器官生理学现象的是各位生物学和医学研究者梦寐以求的目标,而实现这个目标的第一步需要得到可以无限增殖,并能分化成各种组织或器官的干细胞,其可以是从成体来源或者从胚胎来源,后者相较之前者具有全能分化能力。虽然胚胎干细胞是自然界可以直接获取全能的细胞,但是获取难度大而且使用可能会有伦理问题,但是随着2006年诱导多能干细胞(iPSC)技术1的问世这一问题得到很好的解决,可以让研究人员选取任何体细胞进行重编程后变成多能型的干细胞(PSC),然后分化成不同的成体干细胞,最后分化成各种体细胞模,特别是人多能干性(hPSC)可以用来分化成各种细胞,特别是无法出活体实验中得到的细胞。
解决了这个问题后,新的情况出现了,就是2D环境下培养出来的细胞往往只能贴壁在二维环境下生长,但是地球上的生命都是诞生和生长于三维环境中的,维度的缺失让细胞间的相互作用力只存在XY轴,而没有Y轴。此外,三维环境下多层细胞间的渗透效应也缺失了。所以最终在传统2D培养体系中细胞永远只能长成细胞,很多生理学功能无法实现,而且无法形成类似于组织和器官的结构。由此,将有干性细胞和肿瘤细胞在3D环境下进行培养,使其最终能成为类似于正常组织和器官,或相应部位肿瘤的类器官培养技术应运而生。常见的类器官培养方案的祖细胞来源是:成体干细胞和肿瘤细胞,但是这种方法局限于通过活体实验获取此类细胞,而且这一部分是必须在成体内存在的,但是像心肌、脑这种无法在活体获得成体干细胞的组织,就可以使用前面介绍的iPSC通过分化调控来获取。在这个方面的先行者之一是美国辛辛那提儿童医院医学中心的James M. Wells教授,他为iPSC培养消化系统相关类器官建立完整的技术流程。
在2017年他首创从PSC培养出了消化道的类器官2。让建立体外人类器官模型更加方便,因为一般实验室是很难获得人的手术样本,同时也解决了手术获取干细胞的异质性问题;此外,还可以通过精确的分化调控产生出不同的细胞,如可以在培养胃底类器官时候,加BMP4处理48小时可以长出胃壁细胞3;最后,还因为iPSC保留了宿主的全部基因序列(含突变)),所以可以模拟出各个组织因为遗传因素可能出现病变。但是这样培养出来的类器官也有其缺陷,因为毕竟还是在培养皿中进行培养,所以无法形成体内的环境,如神经系统的控制、循环系统对养分的更新,所以这些消化道的类器官不传代的情况下能培养时间一般在2周,最长不过4周,而传代就意味着类器官会被打散,因而造成其能生长的尺寸有限。而James M. Wells教授为此做出了两个解决方案。其一是使用器官芯片技术,在这种微流控芯片中进行培养,这样可以通过芯片的腔室和外置蠕动泵来模拟出体内的循环,从而延长单代次生长时间,进而更大,而且借助液流系统可以方便地控制加入药物和各位微生物或病毒的浓度和时间,便于完成药敏、药代和感染实验4。其二是将培养过的类器官植入在免疫缺陷小鼠的体内,让其可以融合到小鼠的器官上,让类器官可与宿主的神经系统和循环系统融合,不但可以让其长得较之在培养皿中更大,可以达到近千倍,而在最新文章中报道,这种植入的类器官在宿主体内开始发育出布伦纳氏腺这样有分泌功能的复杂结构,从而这种升级版的类器官为让其往器官移植方面的应用建立了基础5。
到这里,是不是大家对James M. Well教授的这套技术路线非常感兴趣呢?但PSC实验流程很长,对分化节点的把握至关重要,因为细胞的状态瞬息万变,如果涉及荧光染色和拍照可能会耽误这些重要节点,从明场观察到的活细胞的状态下就进行后续实验判断非常重要,所以后续部分我们先就以胃类器官为例,将培养过程中涉及明场形态观察的要点进行介绍,具体操作步骤可以点击此链接查看原文。
下图中的明场图像皆来自Leica-Microsystems的S APO体视镜,其拥有复消色差(APO)镜头,可以实现 8:1 变倍比以及高达 80x 的强大放大能力,此类镜头适用于可见光谱及更大范围内最高规格的应用,可以让您方便观察和拍摄干细胞培养过程和分化结果。

hPSC-胃类器官(GOs)培养过程中明场图像解析3:
整个技术流程如图1所示,图1a中介绍了整个流程需要34天,可以从hPSC分化培养成胃窦类器官(hAGOs)和人胃底类器官(hFGOs)。而这2种类器官在前6天(即:Day0-5)处理方式一样,都是分化成后段前肠球体(posterior foregut spheroids),然后包埋到基质胶中,进行后续的处理。而前6天的步骤中,第一阶段前3天需要加入Activin A和BMP4,让hPSC分化成单层的定形的内胚层(DE),其的标记物是SOX17和FOXA2。而第二阶段的3天需要添加Chiron、FGF4、Noggin和RA(第5天加入)形成3D悬浮的前肠球体,其的标记物是HNF1β和SOX2。
然后将悬浮的前肠球体包埋进基质胶中,如果要培养出hAGOs需要添加EGF、Noggin和RA先处理3天,接下来用添加EGF处理3周。如果是培养hFGOs,则是用EGF、CHIR、Noggin和 RA处理3天。在培养体系中,Noggin作为BMP信号通路的抑制剂,可以启动前肠球体的发育;RA让前肠发育成后部前肠,后者的标记物是HNF1B和GATA4。在处理的3天中,经典wnt信号通路的激活可以让GOs形成胃底上皮,CHIR这个小分子可以起到该作用。在Day 9,胃底球体在含有CHIR和EGF的培养基中培养,在Day 20加入FGF10直到流程结束。在Day 30的时候需要降低EGF的浓度,这样可以增加hAGOs和hFGOs中内分泌细胞的数量。在Day 30 对hFGOs 进行48小时的BMP4和PD032591处理可以刺激其产生胃壁细胞。
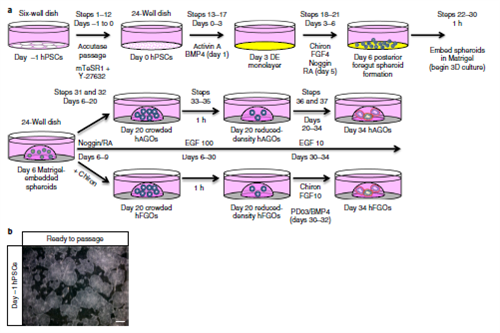
图1 培育和分化流程。

图2 | 第0-3天,观察目标hPSC细胞的适当汇合度,以确保hPSC能分化为DE和稳定生成后部前肠球状体。 a. 细胞按不同比例进行单细胞传代后1天,hPSC的第0天图像,三组图片分别展示了低、目标和过高的汇合度。a组上部分别是传代后的hPSC在低倍放大的情况想下低的汇合度(左)、目标汇合度(中)和过于密集的汇合度(右)。而a组下部依次是低的汇合度(左)、目标汇合度(中)和过于密集的汇合度(右)。b. 第3天,在3天Activin A处理结束时,达到目标汇度的DE细胞单层的低倍(顶部)和高倍(中间和底部)图像。c. 第6天预期的球状体生成低倍图像,生成结果为差(左)、旺盛(中间)和中等(右)。a,b. 在图像采集前更换培养基以去除细胞碎片。比例尺,1mm(a,b(顶部和中心),c);250 μm(b,底部)。【注:因为要保证各个图像的亮度匹配,所以对a中顶部图像的亮度进行了调整。】
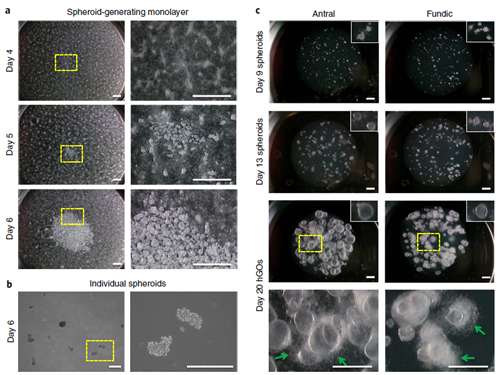
图3 - 第4-20天,后前肠球状体生成、hAGOs和hFGOs在基质胶中生长相关的形态学变化。a. (上排),第4天的低倍(左)和高倍(右)放大图像,整个孔中出现了可以形成球状体的单层细胞,表现为3D出芽形态。(中排)第5天,可以形成球状体的单层细胞的低倍(左)和高倍(右)放大图像,因为3D形态形成了许多贴壁的出芽球状体和一些自由漂浮的球状体。(下排)第6天的低倍(左)和高倍(右),可以形成球状体的单层细胞(其中有大量可以进行收集的自由漂浮球状体),单层细胞基本上没有3D出芽形态。b. 第6天,自由漂浮在培养基中的单个球状体的高倍放大图像。来自同一代的球状体在形状和大小上各不相同,但都被包被在基质胶中以备将来生长。c. 在基质胶中的胃窦和胃底球状体在第9天(上排)、第13天(第二排)和第20天(第三排)长成hGO的低倍倍放大图像。插图显示了基质胶中单个球状体的放大图像。(下排)第20天高倍放大的hAGO和hFGO图像,有大量非计划的神经生长(绿色箭头)。在选择hGO作进一步培养时,应避免选择这种hGO,以减少密度。比例尺,1 mm(a,c),250μm(b)。白色方框内的插图是5倍数字放大的图像;插图的宽度为~833μm(c)。【注:对c的上排图像亮度进行了调整,以使其与其他图像的亮度匹配。】
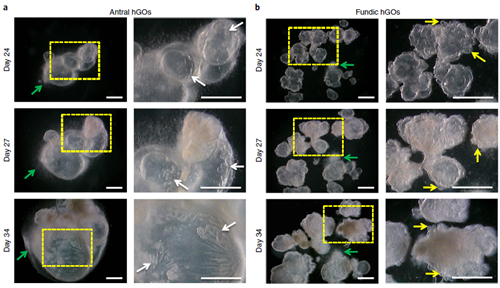
图4 – 降低了EGF浓度后,在基质胶中生长的hGO中胃窦和胃壁细胞的状态。 白色箭头指示hAGO发育出的内部腺体。黄色箭头表示在hFGO中发育出外部腺体的出芽。绿色箭头指示了一个在低EGF浓度下发育出来的神经丛。a,b,在Day 24(上排)、27(中排)和34(下排),在基质胶中生长的hAGO和hFGO的低倍(左)和高倍(右)放大图像。a(下排),发育后的hAGO显示有清晰的管腔和旺盛的内部腺体。b(下排),发育后的hFGOs显示有旺盛的外部腺体出芽,腔内可能含有或不含有很多细胞碎片。比例尺,1 mm。【注:对下排图像的亮度进行了调整,以使其与其他图像的亮度匹配。】
下一篇将会为大家带来类器官移植到免疫缺陷小鼠的操作流程解析。
1. Kazutoshi Takahashi, Shinya Yamanaka. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell 126, 663–676.
2. McCauley, H.A., and Wells, J.M. (2017). Pluripotent stem cell-derived organoids: using principles of developmental biology to grow human tissues in a dish. Development 144, 958–962.
3. Taylor R. Broda. Et al. (2018) Generation of human antral and fundic gastric organoids from pluripotent stem cells. Nature Protocol 14, pages28–50
4. Kang Kug Leea. Et al. (2018) Human stomach-on-a-chip with luminal flow and peristaltic-like motility. Lab Chip 18(20): 3079–3085.
5. Alexandra K. Eicher. Et al. (2022) Functional human gastrointestinal organoids can be engineered from three primary germ layers derived separately from pluripotent stem cells. Cell Stem Cell 29, 36–51