学习如何从共聚焦图像中去除自发荧光
了解自发荧光的常见原因以及如何将其从共聚焦显微镜图像中去除。根据应用的不同,自发荧光的来源可能有很多种,但幸运的是,同样也有很多的解决方案--从更换介质到使用荧光寿命成像和近红外染料。
引言
荧光显微镜彻底改变了我们对生物学的理解。在细胞内以高空间分辨率定位特定分子事件的能力使人们对从基因表达通路到药物相互作用的一切都有了深入的了解。
随着现代共聚焦显微镜技术的进步,其灵敏度也在不断提高。就像任何高灵敏的测量一样,一个根本的问题是信噪比,背景噪声可能会掩盖信号中的微小变化。
在荧光共聚焦显微镜中,最大的噪声源之一是自发荧光。去除这种背景对于能够理解样本中存在的信号的细微差别是至关重要的。在这篇综述中,我们将探索如何通过一些快速固定方法和一些现代技术,如荧光寿命成像,来消除自体荧光,这些技术在软件和显微硬件的进步下变得更容易使用。
自发荧光产生的原因
自发荧光有许多潜在的原因,而且在单个样品中通常有多个来源。首先,细胞本身可能是内源性自发荧光的来源。一些常见的来源是NADH,黄素,脂褐素,胶原和弹性蛋白,以及植物样品中的叶绿素和木质素。换句话说,他们很难摆脱。
除了细胞自身组分带来的自发荧光外,样品在成像前的处理过程也会引入额外的背景荧光。这可以是任何东西,从药物处理到封片剂。在尝试去除自发荧光之前,确定其来源是很重要的。
消除自发荧光的方法
了解你的样品
如果你遇到了自发荧光的问题,首先要做的是尝试通过调查你的样本来隔离根源。当你开始你的实验时,制备一个未标记的对照样品,以确定染色过程是否会带来背景荧光。
了解你的自发荧光光谱也很重要。这可以使用光谱扫描来确定。光谱扫描将有助于实验优化和避免自发荧光中的强信号区。
优化荧光团
一旦你对你的自发荧光光谱有了一个很好的了解,下一步就是优化你的荧光团选择。如果自发荧光和你的荧光团的光谱非常紧密地重叠,那么你的信号很有可能会被自发荧光所掩盖。在这种情况下,选择光谱远离背景自发荧光的荧光团。例如,如果你的自发荧光在光谱的蓝色区域,把你的荧光团移到绿色或红色。
在选择荧光团时,请选择新型探针,如Alexa Fluor、Dylight或ATTO。这些染料往往更亮、更稳定,而且激发和发射波段更窄,这使得只从荧光团中选择信号变得更容易。如果你的显微镜能检测到它们,近红外染料是避免自发荧光问题的一个很好的方法,因为这些波长在生物样本中很少发现。能够检测到近红外染料还有一个额外的好处,那就是能够扩大可用于多色实验的通道数量。
选择荧光团后,不要盲目使用包装上列出的浓度进行实验,这一点很重要。通常情况下,需要对荧光团进行滴定实验,在你的样本上测试不同的浓度。这可以让你看看种浓度与能够获得最好的背景反差,哪种浓度能够获得最低的自发荧光。使用制造商的说明书作为指南,建立荧光团的稀释梯度,覆盖范围略大于推荐的范围。对照你的样品测试这些稀释液,找出哪个能给你最合适的信号。
优化您的显微镜设置
共聚焦显微镜上的设置能够大大影响在你的图像中的目标信号和自发荧光。您可以通过调整光谱检测范围来尽可能多地减少自发荧光信号。根据显微镜的不同,有不同的方法可以做到这一点,但最灵活的选择是选择白激光和光谱式检测器。这意味着你可以精确地调节到达样品的光的波长以及通过检测器的波长。可以对记录在捕获图像中的信号时进行非常精细的控制,并提供充分的机会来消除自发荧光。
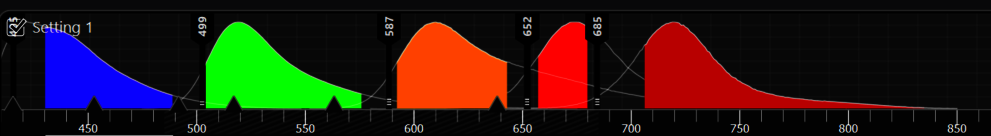
图1:当比较自发荧光和荧光团的光谱时,选择一个与自发荧光信号不重叠的荧光团。
处理你的样本
以避免自发荧光 自发荧光通常不是来自样本,而是来自成像前的处理过程。例如,包埋剂、组织培养液和实验室塑料器皿都可能是自发荧光的来源。
如果你正在进行活细胞成像实验,那么考虑在成像前用预热的无酚红培养基或透明的缓冲盐水溶液替换你的正常培养液。除了pH指示剂酚红(440 nm可以激发出高强度荧光)外,培养基和补充剂(如FBS)还可以包含许多蛋白质和小分子,它们本身就有荧光信号,如果不去除它们,所有这些都可以形成强大的自发荧光背景。如果您确实决定将细胞切换到一种新的培养基进行实时成像,重要的是要意识到这可能会导致细胞行为和表型发生意想不到的变化,因此根据您正在研究的内容,您可能需要首先使细胞适应新的培养基。
用同样的显微镜装置预先测量培养皿的自发荧光也是必要的,看看这是否是自发荧光的来源。如果是这样的话,试着去除自发荧光的玻璃底培养皿。
在对暴露于化学物质的活检和组织样本进行成像时,也可以看到类似的问题。一个常见的例子是消化道,如果它暴露在具有强烈荧光特征的抗生素(如四环素)中,它可能会有大量的自发荧光。在这种情况下,用缓冲盐水彻底冲洗或小心使用溶剂就可以很容易地去除荧光。
如果你需要固定细胞,固定方法会对自发荧光有很大的影响。考虑使用福尔马林和戊二醛的替代品,在成像前尽量不要储存固定样本太长时间,因为自发荧光会随着时间的推移而增加。
软件
虽然通过实验设计避免自发荧光是最好的,但有时这是不可能的。在这些情况下,可以通过计算解决你的自发荧光问题。使用您的显微镜软件或开源解决方案(如ImageJ),可以分析包含自发荧光的像素,并尝试将其从整体图像中减去[1]。不过,请注意,计算方法可能很复杂。有许多不同的方法和算法可供选择,所以最好多尝试几种方法和算法,看看哪种效果好。重要的是要记住,这些方法通常会降低荧光团信号和自发荧光的强度,所以要小心使用,要知道在增加背景的对比度和降低信号强度之间通常是需要权衡的。 软件 虽然通过实验设计避免自发荧光是最好的,但有时这是不可能的。在这些情况下,可以通过计算解决你的自发荧光问题。使用您的显微镜软件或开源解决方案(如ImageJ),可以分析包含自发荧光的像素,并尝试将其从整体图像中减去[1]。不过,请注意,计算方法可能很复杂。有许多不同的方法和算法可供选择,所以最好多尝试几种方法和算法,看看哪种效果好。重要的是要记住,这些方法通常会降低荧光团信号和自发荧光的强度,所以要小心使用,要知道在增加背景的对比度和降低信号强度之间通常是需要权衡的。
固定后去除自发荧光
一旦你准备好样品并将其储存在冰箱里,就会觉得任何自发荧光都会一直存在。虽然在样品制备阶段消除自发荧光比较容易,但即使在处理后也可以采取一些步骤。
有许多化学处理方法可以减弱自发荧光信号。其中一些是商品化可以买到的,而另一些则可以很容易地用常用的实验室化学品如硼氢化钠、苏丹黑B、乙醇铵等来制备[2,3]。
在显微镜下,光漂白往往具有负面含义,在激光调得稍高的情况下,花了很长时间寻找最佳图像后,会失去荧光信号。然而,对于自发荧光,漂白可以是你的朋友。在添加荧光团之前,您可以用高强度LED灯处理您的样品,以漂白所有的背景自发荧光。之后,您选择的荧光团应该能与漂白的背景形成更强烈的对比[4]。
去除自发荧光的进阶方法
显微镜和荧光成像技术在考虑到自发荧光的情况下不断进步。在商用共聚焦显微镜中,有两项创新正变得更加容易获得。
白激光
当涉及到减少自发荧光时,白激光(WLL)提供了很大的灵活性。首先,它们使您能够微调您的激发波长,以匹配您选择的荧光团,同时补充您的样品的自发荧光光谱。
当涉及到荧光团的选择时,白激光也为您提供了最大的灵活性,因为从理论上讲,它们可以让您使用所有已知的光谱荧光染料。波长从440 nm一直到近红外端(790 nm),在处理自发荧光时,激发近红外荧光团的能力特别有利,而自发荧光更常见于光谱的蓝色和绿色波段。
最后,基于光纤的WLL技术能够实现脉冲激发,因此您可以在脉冲之间非常短的间隔内记录荧光信号(计算光子数)。这是时间相关单光子计数(TCSPC)的基本要求,TCSPC是荧光寿命分析的金标准方法。有了WLL功能,FLIM可以内置到您的显微镜设置中,提供一种非常有效和相对简单的方法来减少自发荧光和提高图像对比度。
荧光寿命成像
荧光寿命成像方法可用于消除自发荧光。寿命测量不只依赖于给定波长的荧光强度,而是反映了荧光团处于激发状态的时间,这通常是纳秒级的。这是非常有用的,因为你的背景自发荧光和你的荧光团有重叠光谱的可能性相对较高。然而,它们具有相同寿命的可能性要小得多。这意味着寿命测量可以用来区分自发荧光和你的荧光团信号,即使它们看起来在相同的光谱范围内。以这种方式区分荧光信号的能力意味着,使用寿命测量可以从几乎任何荧光信号中收集有意义的信息,甚至包括自发荧光。虽然寿命测量传统上是一项相对复杂的技术,但硬件和软件的改进使其更容易整合到任何共焦显微镜工作流程中。
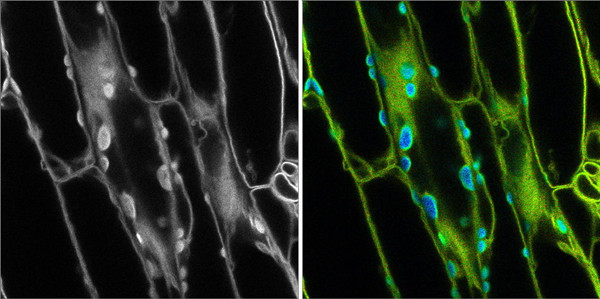
图2:左边的荧光显微镜图像,不能区分荧光信号和背景自发荧光。在右边的图像中,
荧光寿命被用来区分叶绿体中的自发荧光(蓝色)和所需的细胞膜荧光信号(绿色)。
总结和结论
自发荧光不一定会毁了你的实验
当你只有有限数量的珍贵样本时,重要的是不要让任何东西影响你的实验数据的质量。自发荧光是一种常见的现象,如果你听之任之,它可能会毁了你的实验。然而,对于自发荧光,有很多解决方案,从简单地改变在样品处理过程中使用的试剂到使用技术先进的显微镜和检测器。
为自发荧光做好准备是阻止它影响你实验的最好方法。通过做好准备,你可以在实验设计中做出减少或完全消除背景荧光的选择。
- J. M. Powell, N. W. Plummer, E. L. Scappini, C. J. Tucker and a. P. Jensen, „DEFiNE: A Method for Enhancement and Quantification of Fluorescently Labeled Axons,“ Front Neuroanat, 2018.
- W. Baschong, R. Suetterlin and R. Laeng, „Control of autofluorescence of archival formaldehyde-fixed, paraffin-embedded tissue in confocal laser scanning microscopy (CLSM).,“ J Histochem Cytochem, vol. 49, no. 12, 2001.
- M. Viegas, T. Martins, F. Seco and A. do Carmo, „An improved and cost-effective methodology for the reduction of autofluorescence in direct immunofluorescence studies on formalin-fixed paraffin-embedded tissues.,“ Eur J Histochem, vol. 51, no. 1, 2007.
- S. Y, I. P and C. A, „Simple Elimination of Background Fluorescence in Formalin-Fixed Human Brain Tissue for Immunofluorescence Microscopy.,“ J Vis Exp, no. 127, 2017.