Neuron︱Leica高压冷冻颠覆脑片突触研究
Flash and Freeze
神经科学的一个基本问题是:突触的结构和功能特性之间的关系是什么?在过去的几十年里,电生理学已经阐明了突触的传导机制,而电子显微镜(EM)使人们对突触的形态有了更深入的了解。将突触生理学和超微结构联系起来的方法可以追溯到20世纪中期,目的在于获得突触传递的图像,即从电镜拍摄的静态图片中捕捉动态过程。其中一种被称为“闪光与冻结”(flash and freeze)的技术,结合了高压冷冻(high-pressure freezing,HPF),对识别出的突触前神经元的光发生刺激。
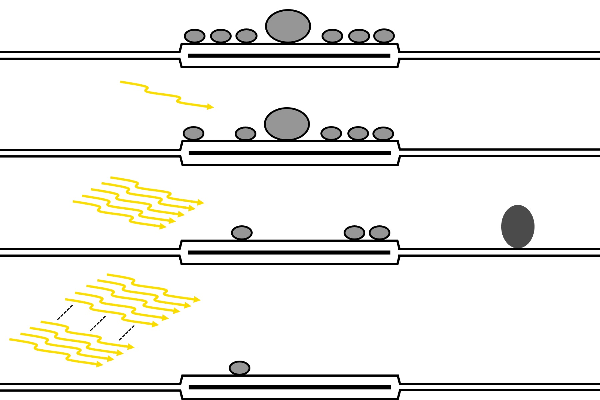
图1 “闪光冷冻”示意图
今天为大家介绍一种新颖的、可用于完整的哺乳动物急性脑切片和器官切片培养的快速和冷冻方法,该方法探索了小鼠海马齿状回颗粒细胞(gyrus granule cell)与CA3锥体神经元之间的海马苔藓纤维突触(hippocampal mossy fiber synapse)的结构和功能,囊泡池的变化。
内容摘要
神经科学的主要重点是进一步理解突触的结构和功能,以及两者之间的关系。尽管对突触传递的认知有了重要进展,但仍有许多问题没有得到解答。由于中枢突触的分子组成、结构和功能高度多样化,因此对突触进行精确分析对逾越这些知识鸿沟大有裨益。
电镜提供了具有纳米级别的空间分辨率,然而它有一个很明显的缺点就是只能捕捉静态图像。为了分析活标本中的突触,通常使用共聚焦、双光子和超高分辨技术成像,然而这些技术经常用于离体培养的神经元,很难达到足够的分辨率来识别单个的激活区或单个突触囊泡。因此,想要洞悉中枢突触的结构-功能关系,需要寻找一项兼顾捕捉纳米级空间和毫秒级时间分辨率的技术。
与以往报道方法不同的是,这种改进的“闪光与冷冻”技术,可应用于急性切片和类器官切片培养。这些优势源于使用了薄的急性切片、改进后的载体几何结构、恢复方案及低温保护和冷冻技术。
基于这一依据,这一技术被应用于海马齿状回颗粒细胞(gyrus granule cell)与CA3锥体神经元之间的海马苔藓纤维突触(hippocampal mossy fiber synapse)。苔藓纤维突触具有大突触末端,形态超微结构明显,突触囊泡数量多,囊泡直径变化大,存在致密的核囊泡。从生理学角度看,该突触初始释放概率低、突触可塑性高。
实验方法
选择专用于研究突触前神经元的转基因小鼠,Prox1启动子靶向这些样本的齿状回颗粒细胞。将pro1-creert2系与Ai32(ChR2(H134R)-EYFP)小鼠杂交,选择性表达通道型视紫红质。借助免疫荧光和共聚焦显微镜观测EYFP在颗粒细胞中的选择性表达。急性切片制备与器官切片培养方式如前所述,使海马苔藓纤维保持最佳状态,以用于电生理学和高压冷冻(HPF)实验。
首先,对急性切片与器官切片培养中光刺激下的突触传导进行了深入的电生理学特征分析,以确定“闪光冷冻”实验的最佳参数,比如脉冲持续的时间和频率。为了匹配EM ICE高压冷冻系统,需注意控制刺激的功率和强度。

图2 优化后的“闪光冷冻”技术工作流
接下来,借助EM ICE系统进行高压冷冻和光刺激,使用EM AFS或EM AFS2进行冷冻替代。用杜氏树脂对切片和器官培养物进行包埋,然后用EM UC7冷冻超薄切片机制成超薄切片。
最后用透射电镜(TEM)观察样品。根据苔藓纤维的特性和形态差异,在海马CA3区发现了苔藓纤维末端。重点分析对照组和实验组中活动区的着位囊泡的数量和直径,以及在半活动区的潜在内吞凹陷形成。
实验结果
“闪光冷冻”电镜的拍摄的HPF小鼠急性脑片海马CA3区图像如下:A)低倍镜图像显示青苔状纤维轴突(绿色箭头)穿过透明层,CA3锥体神经元树突(蓝色箭头)穿过青苔状纤维,少量青苔状纤维(红色箭头)位于这些树突和轴突之间。B)高倍镜图像显示苔藓纤维(红色箭头)布满突触囊泡和苔藓纤维轴突(绿色箭头)。优化后的实验体系保留了急性切片最佳超微结构,可媲美无光遗传学刺激的HPF类器官脑片的超微结构。

图3 HPF急性切片的EM图像
结果显示,“未释放”囊泡池(the docked vesicle pool)和在和“已释放”囊泡池(the functionally defined readily releasable pool)之间有重叠,即两种囊泡具有共同的结构和功能部分,这为随后突触的快速内吞作用提供了证据。
此外,作者展示了中度刺激后内吞的孔状结构外观,提供了快速网格蛋白独立的内吞机制的结构证据。
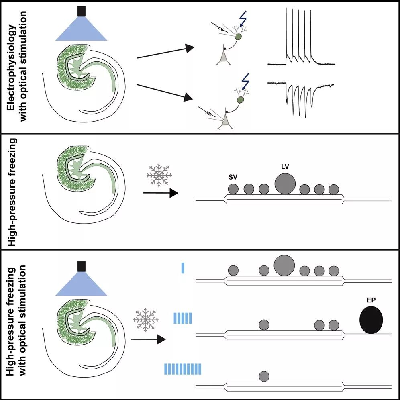
图4 结果示意图
实验结论
这项研究表明了了“闪光冷冻”技术的广泛适用性,可用于小鼠海马组织的急性切片和器官切片培养,也可用于包括小脑和脑干在内的多种大脑区域的急性切片。
总的来说,这一整体升级后的“EM”技术可用于急性大脑切片突触传递过程中的多个时间节点的囊泡池变化(结构和功能)机制研究。
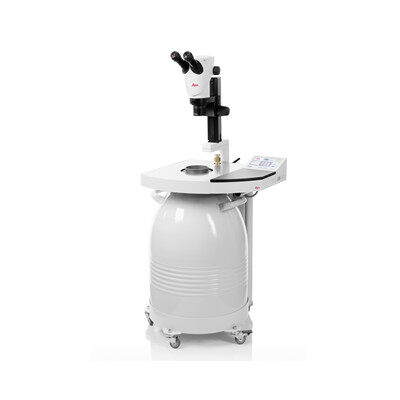
高压冷冻仪 Leica EM ICE
高压冷冻能够捕捉精细结构和细胞动力学的错综变化,结合光刺激或电刺激的高压冷冻技术是您获得新发现的平台。
同步到毫秒的冻结和刺激能够冻结您最感兴趣的那一刻
以纳米尺度和毫秒时间精度冻结和解析高动态过程
- 在高压下冷冻固定您的含水样品,并发现世界的秘密
欢迎点击,了解更多Leica冷冻制备系统