病毒侵染动态研究莫发愁,FLIM-FRET显身手
齐瑶
2020年, “病毒“这个词反复出现在公众的视野里。当我们在感慨着病毒凶猛、人类渺小和生命无常的同时,对于病毒以及相关的研究技术,我们又了解多少呢?
研究难点
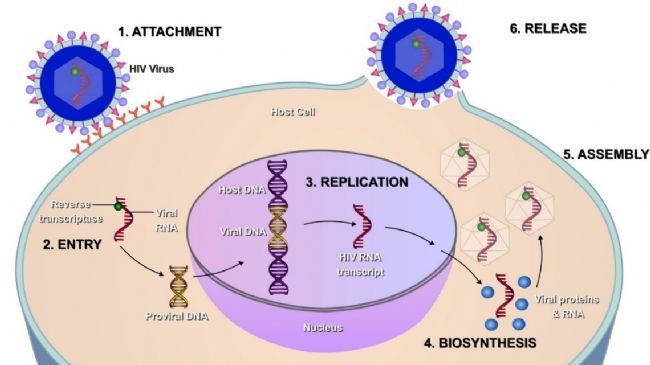
病毒是一种个体微小、结构简单、只含一种核酸(DNA或RNA)、必须在活细胞内寄生并以复制方式增殖的非细胞型生物。而病毒侵染宿主细胞却是一个非常复杂的过程,主要分为吸附(Attachment)、进入(Entry/Penetration)、复制(Replication)、大分子合成(Biosynthesis)、装配(Assembly)、释放(Release)等几个阶段,如图1。
如何从初始的吸附和进入阶段进行干预阻断,是病毒性疾病防治的切入点之一。以人类免疫缺陷病毒(HIV),也就是引发艾滋病的病原为例,它通过颗粒表面的包膜糖蛋白(Env)与免疫细胞表面的CD4分子、辅助受体互作,实现病毒与宿主细胞的融合、感染过程。科学家们曾运用BlaM(β-内酰胺酶分析:测量细胞群中病毒融合的技术)或细胞内病毒衣壳蛋白p24分析等多种方法对病毒的侵染过程进行检测,但由于技术的限制,均不能直接实时监测病毒进入宿主细胞的动态融合过程[2]。因此,在时间和空间上都具备高灵敏度的FLIM-FRET,成为了该项研究的破冰技术。
FLIM-FRET
经常关注徕卡课堂的同学们,想必对FLIM-FRET都不陌生了。在这里,我们再简单回顾一下几个关键性的概念。
荧光寿命:荧光是指荧光分子吸收能量后,其处于基态(S0)的电子跃迁至激发态(S1),经过短暂停留,由激发态(S1)再回到基态(S0)时释放出光的现象,而荧光分子停留在激发态的时间就是荧光寿命(图2A)。与荧光光谱一样,荧光寿命也是荧光物质的一种内在特有性质。
FLIM(Fluorescence Lifetime Imaging,荧光寿命成像):是一种基于荧光寿命的显微成像技术,其成像结果提供像素位点的寿命信息(如图2B),使得我们在荧光强度成像之外,能更加深入地对样品进行功能性测量。荧光寿命成像具有不同于荧光强度成像的众多优点,如不受荧光物质浓度、光漂白、激发光强度等因素的影响。但会因为分子构象、分子间相互作用、分子微环境、生理状态等条件改变而发生变化,因此荧光寿命可用于分析分子的这些变化,基于荧光寿命测量的FRET是FLIM的重要应用之一。
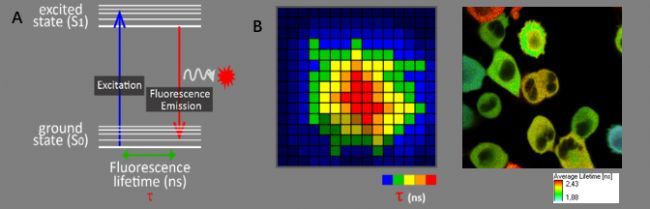
图2. A. 荧光寿命示意图;B. FLIM:提供每个像素位点的荧光寿命信息(左);基于荧光寿命信息的细胞成像结果(右)
FRET(Fluorescence Resonance Energy Transfer,荧光共振能量转移):供体荧光基团(Donor)的发射光谱与受体荧光基团(Acceptor)的吸收光谱有一定的重叠,当供体被激发后,且两个荧光基团间的距离小于10nm时,处于激发态的供体将把一部分或全部能量转移给受体,使受体被激发,即发生荧光能量的非放射性转移现象,为FRET(如图3),这一过程也伴随着供体荧光寿命的缩短和受体荧光寿命的延长。

图3. FRET原理(左)[2]及FRET实例(右)
FLIM-FRET兼具 FLIM 和 FRET 两者的优势,不受荧光物质浓度、光漂白、激发光强度等因素的影响,且样品制备简单,测量结果准确性高,易重复。因此,FLIM-FRET非常适合于进行分子间相互作用、分子构象或生理状态改变等的研究。
应用实例
那么科学家是如何将FLIM-FRET应用于监测HIV病毒侵入宿主细胞的动态过程呢,让我们看以下两个实例:
(一) 利用FRET生物传感器示踪HIV进入宿主细胞过程[3]
来自牛津大学的研究者设计了一个HIV-Chameleon生物传感器,由一对能够发生FRET的荧光团(mTFP1和eYFP)组成,两个荧光团之间通过短肽序列(包含烟草蚀刻病毒TEV蛋白酶切割位点)链接在一起(如图4A右)。TEV蛋白酶(TEVp)可以与HIV-1 Vpr蛋白或Gag蛋白融合,掺入病毒颗粒中。当包含TEV蛋白酶的病毒与表达生物传感器的细胞融合时,Vpr-TEV或Gag-TEV(rTEV)被释放到细胞质中,并特异性地裂解链接序列,增加mTFP1与eYFP之间距离至10nm以上,阻断FRET,并可通过FLIM进行测量。图4B为FLIM伪彩图与图像中所有像素的寿命直方图,其中蓝色表示较短的寿命(无融合),红色表示较长的寿命(融合)。这样就可以实时定量荧光寿命的改变,从而示踪病毒与宿主细胞融合的瞬间动态过程。作者将所得结果与广泛使用的BlaM分析结果比对,二者具有高度匹配性,因此,HIV-Chameleon生物传感器与FRET-FLIM的结合使用,可以实现单个活细胞或群体的病毒融合动力学实时监测。
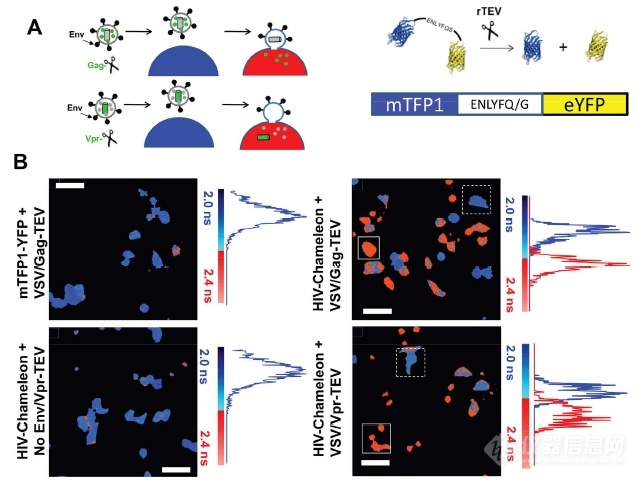
A.(左)TEV蛋白酶(TEVp)与HIV-1 Vpr蛋白或Gag蛋白融合的两种包装过程;(右)HIV-Chameleon生物传感器示意图;B.病毒融合前后的荧光寿命成像(Scale Bar=30μm)
(二) 细胞代谢水平对于HIV-1侵染宿主细胞的影响[4]
研究人员在HIV-1病毒的侵染机制研究中发现,病毒侵染过程中,宿主细胞代谢水平与膜状态改变有关。将FRET生物传感器瞬时转染到细胞中(如图5A),记录瞬时表达这些生物传感器的细胞的FLIM图像,并进行BlaM分析,结果表明,乳酸浓度较高的单细胞与病毒融合性更高,此外,具有更高ATP/ADP比率的细胞与病毒的融合性更高(如图5B)。也就是说,糖酵解通量较高的细胞更容易被HIV-1感染。

图5. 单个细胞中的相对乳酸浓度和ATP / ADP比率与HIV-1融合相关[4];
(A)FRET生物传感器;(B)同样区域细胞的BlaM(上)和FLIM成像(下),白色实线所示为正在与病毒融合的细胞,在BlaM中呈红色,荧光寿命较长,白色虚线所示为未融合的细胞,BlaM中呈绿色,荧光寿命较短
进一步的分析表明,2-脱氧-d-葡萄糖(2-DG)对糖酵解的靶向抑制作用大大降低了HIV-1的融合和感染。而用2-DG处理的细胞分别具有较低的膜胆固醇和较高的膜张力值。因此,作者构建了一种基于Ypet/eCFP FRET的膜张力感应器MSS,由一个弹性张力传感模块和两个与脂分子连接的蛋白质组成,这两个蛋白质锚定在质膜的Raft和非Raft区域,对膜张力变化非常敏感(如图6)。通过FLIM测量单个细胞MSS张力探针瞬时表达,证实了HIV-1需要在膜张力较低的区域进入细胞,也进一步确定了宿主细胞糖酵解活性和膜张力之间的联系,其在活细胞中的单病毒融合水平上实时影响HIV-1融合。
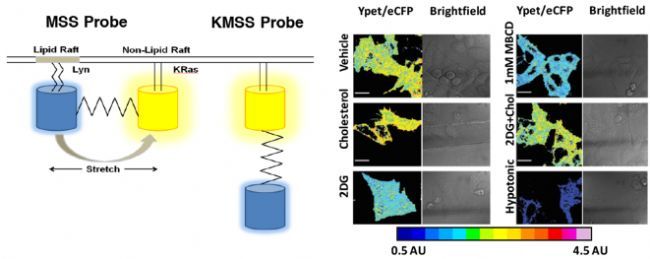
图6.(左)灵敏型膜张力感应器MSS探针以及对照组非灵敏型感应器KMSS探针示意图;(右)多种不同处理条件下,TZM-bl 细胞表达MSS的FRET效率成像[4]
总结
FLIM-FRET提供了基于群体方法或光谱方法所难以实现的单细胞微环境中的分辨率,能以高时空分辨率在单个细胞中可视化和识别影响HIV-1感染的关键因素,实现单一病毒跟踪技术。这对于在HIV-1感染早期阶段寻找艾滋病的治疗方法,有着重要的科学意义。
创新、高效的技术和设备,是科研工作者们揭示生命奥义的得力工具,也是在面对新型突发病毒时的尖兵利器。Leica全新 STELLARIS 8 FALCON荧光寿命成像系统,搭载新一代白激光(440-790nm)以及HyD X高灵敏度专用检测器,提供超快速、多维度荧光寿命成像解决方案。想了解更多关于Leica STELLARIS 8 FALCON产品信息或病毒的研究方法,敬请关注徕卡的微信公众号,我们下期再见。
[1] https://ricochetscience.com/viruses-human-genome/
[2] Molecular Sensors and Nanodevices (Second Edition). Chapter 5 - Optical transducers: Optical molecular sensing and spectroscopy(2019)
[3] Imaging real-time HIV-1 virion fusion with FRET-based biosensors. Jones DM, Padilla-Parra S. Sci Rep. 2015 Aug 24;5:13449.
[4] Single-cell glycolytic activity regulates membrane tension and HIV-1 fusion. Coomer CA, Carlon-Andres I, Iliopoulou M, Dustin ML, Compeer EB, Compton AA, Padilla-Parra S. PLoS Pathog. 2020 Feb 21;16(2):e1008359.