徕卡共聚焦课堂第18讲:FLIM FRET和生物传感器——用于生物医学研究的多功能工具
荧光寿命成像(FLIM)与荧光共振能量转移(FRET)的结合对生物医学中各种结构元素和细胞动态变化的研究非常有益。FRET可检测分子相互作用,因为FRET信号强烈依赖于两个FRET伙伴的距离。因此FRET可以用来研究分子的相互作用,如配体-受体对、蛋白质-蛋白质相互作用或效应子与DNA的相互作用。另一方面,FRET原理也可用于设计传感器,结合或释放配体时改变探针内两个荧光团的FRET效率。这样的话,我们有两种类型的分子相互作用:传感器中的FRET伙伴以及探针与配体的相互作用。本文解释了分量方法(FLIM和FRET)及其组合如何开拓广泛的应用领域。
作者
· Rolf T. Borlinghaus , Dr.
徕卡显微系统
测量特定参数需要特定的传感器。温度通过温度计测量,速度通过速度计测量。生物医学研究通常需要测量细胞或细胞外液体中的参数。在这里,有无数研究人员感兴趣的参数:例如各种离子、小分子或其他代谢化合物,甚至极性或电势。研究人员希望通过测量这些参数来解开生命、宇宙和一切事物背后的真相。如今,大多数测量生物参数的探针都基于荧光。荧光探针可以提高或降低亮度,具体取决于所研究分析物的浓度。但强度不仅受荧光染料浓度的影响,还受光照强度、漂白导致的退化以及吸收和阴影效应的影响。为了在某种程度上避免这些问题,最好使用比例染料,它能校准荧光染料发射,与属于该荧光染料光谱内的恒定背景进行比较。尽管如此,由于可重复性有限,基于强度的探测并不是很可靠。它还需要精细的校准和校正方法。荧光寿命成像(FLIM)提供了更好的方法。寿命与样品中的染料浓度、光照强度以及吸收和散射无关。因此,这些在实验过程中的变化对寿命没有影响。另一方面,荧光寿命在很大程度上取决于分子环境,这让测量环境参数的影响变得可行。在特殊的分子环境情况下,可能有第二种染料可以吸收第一种染料的激发能量——FRET。该过程为寿命测量提供了一种灵敏方法。对于这种组合技术,越来越多的探针(“分析仪”)被开发并用于生物医学研究:FLIM FRET生物传感器。
什么是FLIM?
荧光的激发发生在具有适当能量的光子中。吸收光子后(蓝色箭头,图1a),电子系统释放少量热量(虚线图1a)。因此,与吸收相比,发射的光子具有更长的波长(图1b)。能量释放可通过与低能量光子(图1c)的相互作用来触发,而非自发发射,这被称为受激发射,是激光辐射和STED显微镜学的基本过程。最后,能量也可以在不发射光子的情况下完全释放,从而降低荧光效率(淬灭,图1d)。

图1:荧光中的量子事件:(a)吸收,蓝色,(b)发射,绿色,(c)受激发射,红色和(d)淬灭。涉及光子的事件以相应颜色的实心箭头显示。非辐射事件以黑色虚线显示。G:基态;E:激发态。
荧光图像通常被认为是发射光的二维强度分布。强度可以作为激发波长或发射波长或两者的函数来测量。发射检测由一系列同时检测到的光谱带、递增的光谱带或二者的组合来执行。结果用于创建彩色图像、分离信号通道、识别空间和时间的相互作用等等。荧光过程提供了额外的信息:荧光寿命,一个不受强度影响的荧光信息。寿命可用于在特定条件下识别和分离荧光物质,并揭示有关分子环境的详细信息。
激发后,荧光分子在激发态停留一段时间,然后衰变回基态。它们停留在激发态的时间不可预测,因为这是量子力学控制的随机过程。对于这种行为,人们比较熟悉的一个例子是不稳定原子核的放射性衰变,它由每个核素具体的半衰期确定。对于荧光,寿命被描述为激发化学物质的特征寿命τ。除了通过强度特性进行分离外,寿命还可以作为区分荧光染料的一种手段。
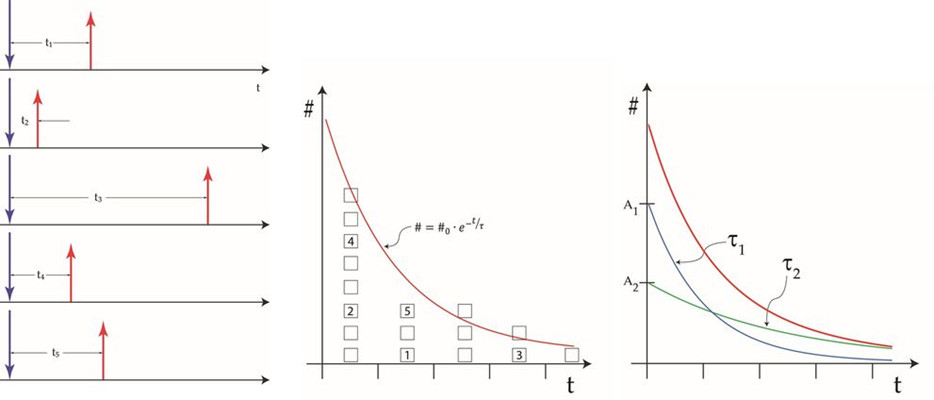
图2:用激光脉冲(蓝色箭头)激发后发射光子(红色箭头)到达时间tᵢ的测量值。此处绘制了5个测量值。b:到达时间的直方图,包括上面五个事件的示例。大多数计数,#,都在很短的时间内。直方图用指数衰减曲线拟合(红色)。c:拟合显示,例如两个单次衰减(蓝色和绿色曲线),衰减时间为τ₁和τ₂,振幅为A1和A2。这些数字的总和将等于红色衰减曲线。
因此,荧光寿命图像(FLIM)不代表每个图片元素(像素)的强度,而是提供有关寿命的信息[1]。典型的测量方法(时间相关单光子计数,TCSPC)确实能测量荧光的单个事件。像素信息是“平均到达时间”,即在该像素中测量的所有寿命事件的平均值,或者是通过曲线拟合从到达直方图中提取的一个或多个特征时间(图3)。为获得显著的结果,每个像素应该测量大约400个事件。
什么是FRET?
荧光共振能量转移(FRET)是一种影响荧光测量的淬灭现象。除了发射光子,该分子还可以释放全部激发能量而不发射辐射。(淬灭,图1d)。如果淬灭分子、是荧光染料,则能量通过共振作为能量量子从供体(D)转移到受体(A)荧光染料(图3),无需辐射。这样,释放的能量不会以热量的形式消散,而是储存在受体荧光染料的激发态[2]。为使FRET发生,受体的激发必须与供体的发射在光谱上重叠,并且两个分子也必须紧密接触并处于正确的方向。在这种情况下,“接近”意味着距离不应超过约10纳米。分子越近,出现FRET的可能性就越大。
距离和传输速率kF之间的关系通过以下等式描述:
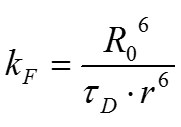
其中R₀表示“福斯特半径”,为转移效率为50%的距离,即一半受激的供体分子可以将一定量的能量转移给受体。福斯特半径为每个供体-受体对假定一个特定值。供体激发的特征寿命通过τD表示,两个分子之间的实际距离由r表示。由于转移速率与分子间距离(升至6次方)成反比,因此FRET 仅在供体和受体紧密接触时发生。这种关系仍是独一无二的,因此最初使用FRET来估计分子距离(“分子标尺”)。此外,绝对FRET效率取决于供体发射和受体激发的重叠积分以及两种荧光染料跃迁矩的方向。
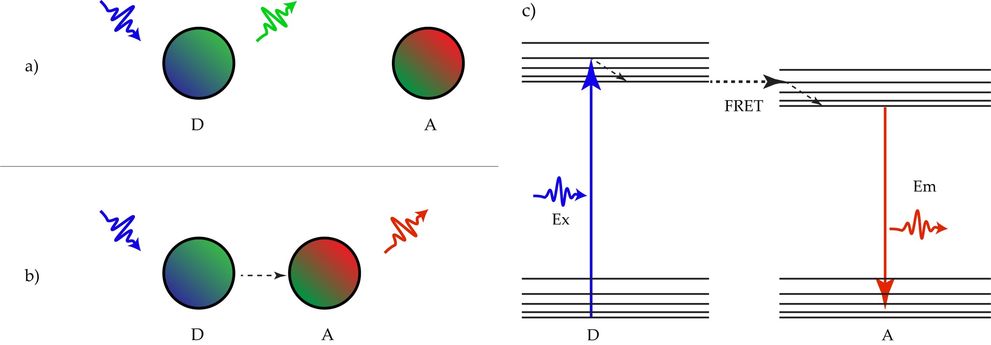
图3:普通荧光和FRET:a)荧光供体分子(D)可以吸收光子(蓝色)并发射能量较低的光子(绿色)。b)或者,能量可以以非辐射的方式(黑色虚线)转移到相邻受体荧光染料(A),其吸收带与D的发射带有重叠区域。与D的发射相比,受体可以发射较低能量的光子(红色)。从D到A的非辐射转移称为“荧光共振能量转移”(FRET)。c) FRET的Jablonski图。供体D由短波长光子Ex激发。能量以非辐射方式(FRET)转移到受体A。受体发射长波长光子Em。
FRET的发生通过几种现象来显示。首先,样品(受体)会发出与施用的激发颜色不同的荧光颜色。对于图3中的示例,在蓝色激发后不会出现红色发射。可以测量这种发射并与原始发射进行比较,这种方法称为“敏化发射”。敏化发射能以可量化的方式表示FRET的发生。这种测量可以在活体材料中进行,但如果在强度模式下进行,则需要复杂的校正,因此容易出现各种校准错误。因此,寿命测量是首选方法。FRET对寿命的影响在最后一节中说明。
另一方面,供体的发射会减少,因为一些激发态会转变为受体激发。这种现象在称为“受体光漂白”的方法中得到利用,该方法通过光漂白消除受体后测量供体发射的变化。去除受体后,供体发射会增加。此方法仅适用于固定样品。
FLIM FRET和生物传感器
为生物来源的传感器选择了“生物传感器”一词。生物传感器可以是蛋白质或肽、DNA或RNA片段、细胞等。甚至整个生物体都可以作为生物传感器,例如毒水污染死亡率筛查设置中的淡水鱼。在更具技术性语境下,生物传感器表示包含生物部分和用于测量分析物浓度的电路的复合传感器。例如众所周知的葡萄糖生物传感器,它是糖尿病患者用来控制血糖的快速、简便仪器。FLIM-FRET生物传感器通常表示使用荧光(寿命)作为信号,并使用FRET作为敏感现象的分子。
到目前为止,我们已经掌握了了解FLIM FRET生物传感器工作原理所需的背景知识。第一部分是感应分子:通常是与分析物(目标分子)相互作用的蛋白质或肽。蛋白质和肽可以通过基因工程轻松引入目标生物体,因此是首选的感应分子。有名的例子是蛋白质钙调素。钙调蛋白可以结合Ca2+离子,并在结合或解离时发生构象变化。
第二部分与荧光有关。我们需要用一对可进行能量转移的荧光染料来标记感应分子。荧光染料在连接到感应分子时,必须在一种构象状态下使它们相距很远并且不能进行能量转移,但在另一种构象状态下使它们很近、正确定向并随后进行能量转移。如果传感器之后结合或释放分析物,FRET将发生或消失。我们可以通过敏化发射等来测量结合或释放。如果选择荧光蛋白作为荧光染料,则整个生物传感器可以通过基因表达,因此可以引入任何生物目标对象,甚至是特定的亚细胞位置。例如,合适的配对是作为供体的CFP(青色荧光蛋白)和作为受体的YFP(黄色荧光蛋白)。
最后一位是寿命测量值。如上所述,按强度划分的敏感发射测量值容易出现重大误差,并且需要繁琐的校准测量和复杂的校正。这主要是因为强度受其他很多参数的影响,而不仅仅是对FRET过程有影响的参数。寿命基本上只取决于荧光染料种类和分子环境,在这种情况下,取决于受体的丰度,它是探测机制的基础。在FRET的情况下,与纯荧光发射相比,寿命会缩短。图4中使用水槽(类似于激发态的水槽)的类比来显示该缩短。如果供体只能发射荧光(绿色),则只有一个排水管控制水槽排空速度(a)。如果供体可以将能量转移到受体,则在水槽中打开第二个排水管(红色),水槽将会更快排空(b)。
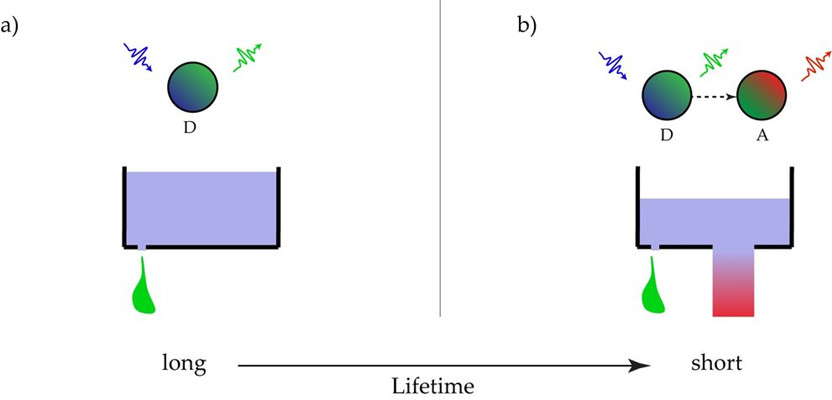
图4:a):在没有FRET的情况下,供体分子的水槽D仅通过发射光子来释放激发能量。因此,激发态的水槽仅通过一个控制激发态平均寿命的排水管(绿色液滴)排空。b):如果受体分子可以吸收来自供体分子的激发能量,则有第二个排水管用于排空激发态的水槽。因此,在有FRET的情况下,耗尽速度更快,因此寿命更短。
FRET动力学
供体分子激发态ED的荧光衰减在被闪光激发后会简单地衰减到基态GD并发射荧光光子pD:
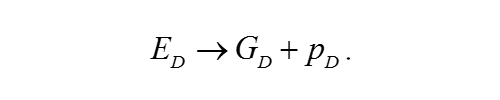
对应的速率方程为:
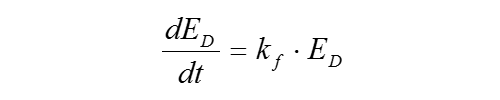
其中kf是荧光发射的反应速率。积分收益率

其中E0D表示闪光后的初始激发态数,tf表示特征时间(tf=1/kf)。FRET淬灭过程与普通荧光竞争,通过非辐射过程产生激发的受体分子EA,因此:
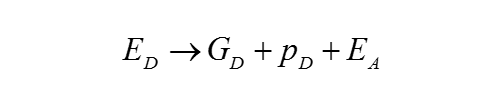
在这种情况下,knr表示非辐射传输率:
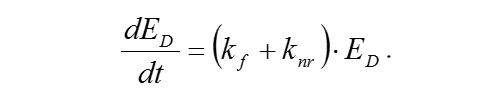
当荧光共振能量转移发生时,表观特征时间τFRET短于纯荧光发射的特征时间tf:

这种寿命差异用于检测传感器在结合特定分析物(分子内FRET)时的构象变化。当然,可以以相同的方式(分子间FRET)研究被相应FRET伙伴覆盖的两个分子之间的任何相互作用。
因此,如果我们测量供体的寿命变化,可以监测感测剂的构象转换,从而监测分析物浓度的变化。如果结合构象导致FRET 降低,供体寿命将随着分析物浓度而增加,反之亦然。
如要以足够的精度和速度测量荧光寿命以了解体内动态变化,仪器必须具备高灵敏度、允许快速帧速率以及拥有探索时间相关单光子计数边界的适当方法[3]。
FLIM-FRET测量示例
为说明FLIM-FRET在现代生物医学科学中的作用,下面将举几个例子。FLIM FRET 应用不仅涵盖用于分析物检测的生物传感器,还涵盖蛋白质、肽、核酸等的各种相互作用。通常,使用具有青色和黄色发射的荧光蛋白CFP和YFP或衍生物。为了提高可读性,草图用绿色和红色显示这些发射。
Ca2+离子在细胞生理学中发挥很多重要作用,例如在细胞信号传导中作为第二信使。它是肌肉收缩的必要成分,能够释放神经递质,并促进活细胞的膜电位。它也是很多酶反应和凝血的重要因素。
如要研究这些功能,必须拥有一种能在活细胞内快速、灵活操作的探针。一个标准的FLIM-FRET生物传感器示例:Ca2+指示剂“cameleon”,是一种钙计(参考引言段)。“cameleon”有很多种,这个名字表示它对Ca的敏感性及颜色变化,就像变色龙一样[4]。
Cameleon探针中的感应剂是可结合Ca的蛋白钙调素。它在与钙结合后发生构象变化。具有两种荧光蛋白(例如CFP和YFP)的构建体构成了FRET生物传感器(见图5)。

图5:左侧:不含钙的传感器具荧光蛋白间隔远。无FRET发生,寿命很长。右图:结合Ca²⁺ 后,构建体发生构象变化,使荧光蛋白紧密接触并允许FRET。供体的寿命变短,这是用于监测Ca²⁺ 水平的测量信号。
Cameleon钙传感器在与 Ca2+离子结合后显示FRET,即在有钙的情况下寿命会缩短。
细胞信号传导中同样著名的第二信使是环式AMP (cAMP),它被认为是盘基网柄菌子实体发育过程中的形状协调剂[5]。环式AMP是不通过细胞膜转移的激素的细胞内信使,因此在碳水化合物和脂质代谢中起着关键作用。它还参与某些离子通道的调节。
与cameleon类似,可以通过将cAMP结合蛋白Epac与两种荧光蛋白融合来形成生物传感器[6][7]。
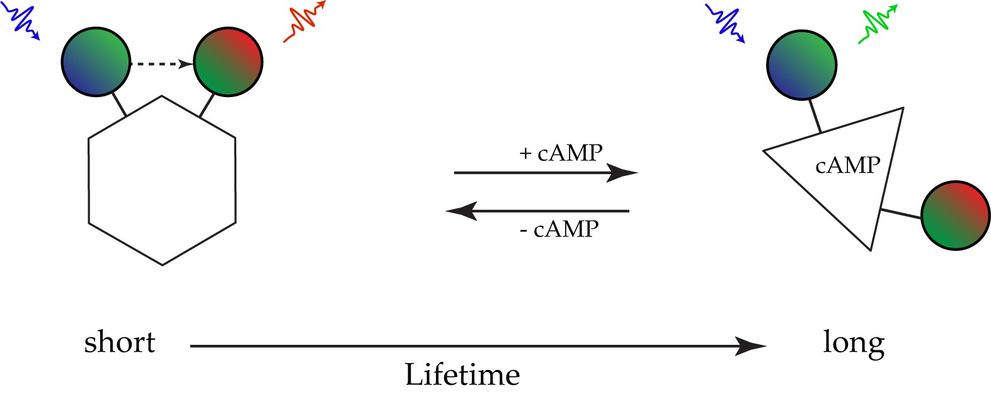
图6:左侧:无cAMP存在时的Epac分子。荧光蛋白紧密接触允许FRET,寿命很短。右图:结合cAMP后,构建体发生构象变化,使荧光蛋白远离并阻止FRET。寿命变长。该变化被用作监测cAMP活动的信号。
cAMP传感器Epac在没有cAMP的情况下显示 FRET,即在存在cAMP时寿命会增加。
另一种方法是非侵入性地绘制3D细胞培养物中代谢状态的空间和时间变化[8]。在此处,FRET生物传感器(T2AMPKAR)用于监测肿瘤球体中AMPK(5' 腺苷酸活化蛋白激酶)的活性。为了对球体进行深部成像,通过双光子激发进行激发。
上述示例只是生物医学研究中可能实现FRET测量的一小部分。蛋白质、配体与受体的相互作用、DNA与蛋白质的相互作用,或DNA片段与RNA的相互作用都可以用荧光方法进行研究。它们中的很多已经用于比色皿荧光测量方法,但也可以用于动态成像。因此,荧光寿命成像领域将在不久的将来显著增加。