徕卡共聚焦课堂第11讲:荧光寿命成像与荧光共振能量转移
体内生化定量
荧光寿命是荧光团在发射荧光光子返回基态之前保持其激发态的平均时间长度。这取决于荧光团的分子组成和纳米环境。
FLIM将寿命测量与成像相结合:对每个图像像素以测得的荧光寿命进行颜色编码,产生额外的图像反差。因此,FLIM可以提供关于荧光分子空间分布的信息和有关其生化状态或纳米环境的信息。 FLIM的典型应用是FLIM-FRET。FRET是研究分子相互作用的成熟技术。它能用来研究蛋白质结合并在埃的尺度上估算分子间的距离。
FRET—原理
荧光共振能量转移(FRET)描述了存储在激发的荧光分子(供体)中的能量向其附近的非激发的荧光分子(受体)的非辐射转移。FRET的发生必须满足三个条件:
- 供体发射光谱与受体激发光谱的重叠(图1)
- 在纳米(10–9 m)级上分子必须非常接近(图2–4)
- 分子必须具有适当的相对方位
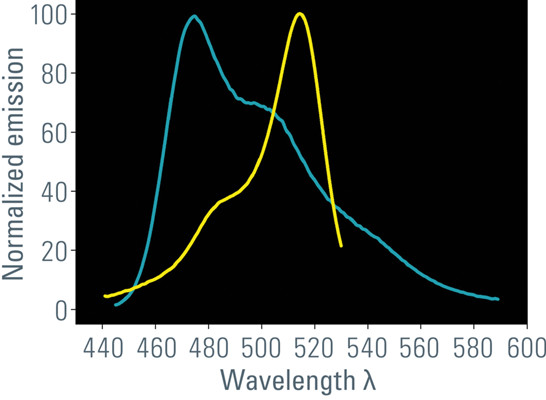
图1:供体的发射光谱(此处为ECFP,蓝线)必须与受体的激发光谱(此处为EYFP,黄线)重叠。这一要求意味着FRET对中的两个分子都具有兼容的能级。
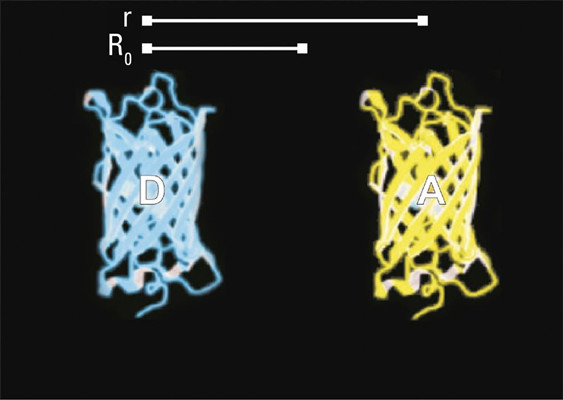
图2:供体分子 (D) 与受体分子 (A) 相隔距离为 r。
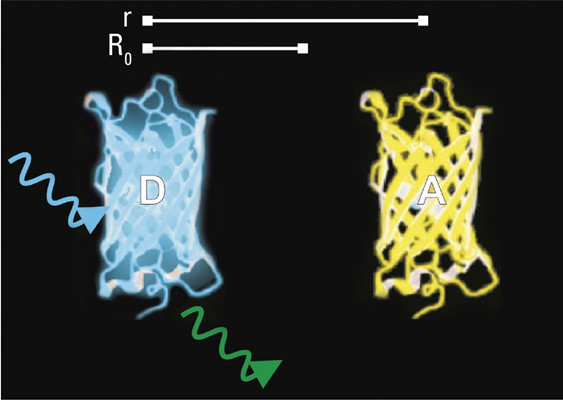
图3:在远大于阈值R0(也称为福斯特半径)的距离r处,无能量转移。
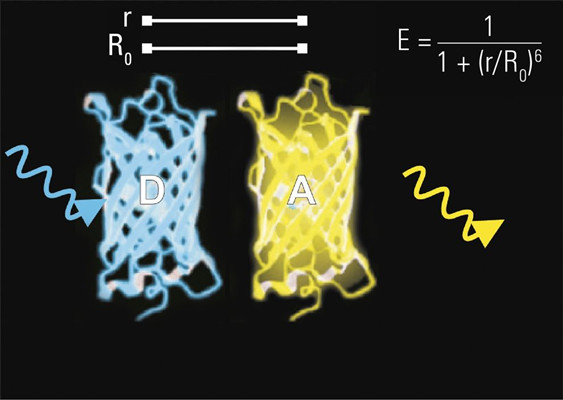
图4:如果分子紧密接触,则来自激发光子(蓝色箭头)的能量以非辐射方式转移到受体。后者又发射光子(黄色箭头)。该过程(E)的效率与r–6密切相关。
影响
由于与r-6密切相关(图4),FRET发生在与生化反应高度相关的空间尺度上,例如蛋白质-蛋白质或蛋白质-DNA相互作用。FRET可以通过灵敏的荧光读数来探测分子间的相互作用。这能让研究人员在体外和体内研究分子相互作用。通过合适的荧光标记将两个相关的相互作用方连接起来,可以分析双分子相互作用。FRET还允许构建生物探针,通过强烈的构象变化导致的分子内FRET来报告第二信使的浓度或离子强度。
FRET无疑已发展成为细胞生物学、生物物理学和生物医学成像中广泛使用的工具。
方法论
有很多技术可以在显微镜环境中检测FRET。常见的的是基于供体(受体光漂白,FRET AB)或受体(敏化发射,FRET SE)荧光强度的技术。
使用标准共聚焦显微镜可以轻松应用基于强度的FRET。但它也存在缺点。FRET AB不能应用于时间序列实验,并且容易受到供体分子的可逆光漂白或光转换的影响。另一方面,FRET SE受到所有FRET对固有光谱串扰的影响,需要仔细的校准测量以及对所得图像的线性拆分。本文介绍了一种基于荧光寿命显微成像 (FLIM) 的FRET测量方法。
荧光寿命
荧光过程通常被理解为分子中从电子基态(S0)到其激发态(S1)的能量跃迁。(图5,左)。这种跃迁可由具有适当能量(即频率或波长)的入射光引起。吸收的能量由荧光分子储存一小段时间,然后才能作为荧光发射。分子处于激发态的时间称为荧光寿命。对于许多有机染料和荧光蛋白,荧光寿命通常为几纳秒(10–9 s)左右。
荧光寿命和FRET
从激发态弛豫的另一种过程是FRET。通过FRET激发,能量以非辐射方式转移到受体分子。然后受体分子以荧光方式弛豫(图5,右)。由于供体发荧光和能量转移是一个相互竞争的过程,因此在存在FRET的情况下,激发态的消耗速率会增加。有人可能会说,供体分子处于激发态的时间越长,发生FRET的可能性就越大。只能观察到来自供体分子且通过荧光弛豫的光子。转移到受体分子的能量由于受体荧光的波长较长而不会被检测到。 因此,FRET缩短了供体荧光寿命(图6)。
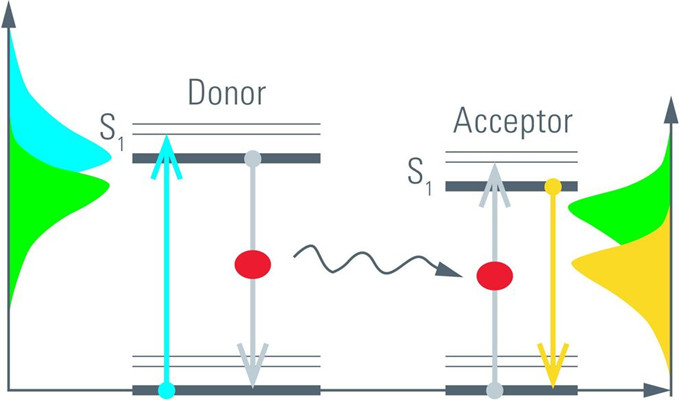
图5:FRET对中的能量跃迁。与供体分子中的跃迁能匹配的光被吸收(蓝色箭头)。激发的供体可以通过荧光(灰色箭头,左)或通过共振能量转移到受体分子(黑色箭头)而弛豫。
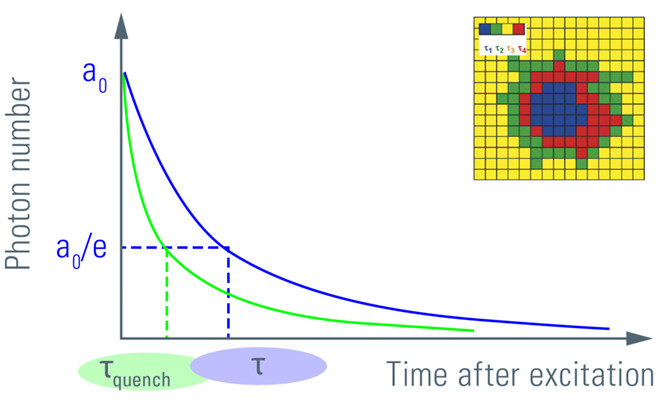
图6:对激发后一段时间内检测到的荧光光子数作图。激发脉冲后发射光子的初始数量a0呈指数衰减。荧光衰减到a0/e (~ 37%)所需的时间为荧光寿命。由于存在FRET (τ-quench),寿命τ变为更短的时间。寿命衰减的另一个读数是振幅a0。测量扫描系统中每个位置的寿命会产生寿命的空间图(见插图)。
荧光寿命成像 (FLIM)
Leica SP8 FALCON使用脉冲激光和单光子计数检测器在时域中测量荧光寿命。通过建立检测到的荧光事件的直方图来确定寿命。可显示单指数或多指数荧光衰减。数值曲线拟合表示荧光寿命和振幅(即检测到的光子数)。
由于FRET减少了供体寿命,因此如果无FRET的供体寿命已知,就可以量化FRET发生的程度。该供体寿命τ作为分析FRET样品的绝对参考。因此,FLIM-FRET为内部参照—这一特点减少了基于强度测量FRET时的很多缺点。由于其荧光寿命是染料的固有特性,因此对其他不利影响(如光漂白、图像明暗处理、不同浓度或表达水平)具有广泛的不变性。
使用基于强度的FRET测量的主要限制是所有可观察的供体分子都经历FRET的基本假设。通常情况并非如此。供体分子这种变化的“非结合”组分给测量的FRET效率带来了相当大的不确定性,使得无法在实验之间进行比较。FLIM-FRET克服了这一缺点。
使用活细胞记录FLIM图像
如前所述,FRET效率根据发生FRET供体的寿命τquench与未发生FRET的寿命τ的比率计算得出:
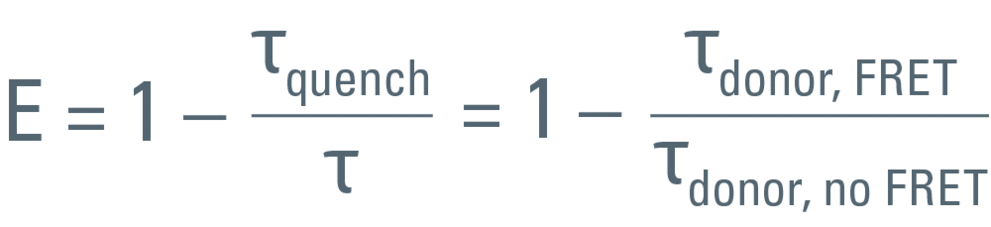
为此,τ必须从仅包含供体的样品进行的测量来获得。必须排除来自受体的任何发射光。外部检测器通常使用带通滤色片。而内部探测器可调节检测范围为只记录供体发射光。测量仅供体样品和FRET样品时必须使用相同的设置。
活细胞中的CFP-YFP FRET
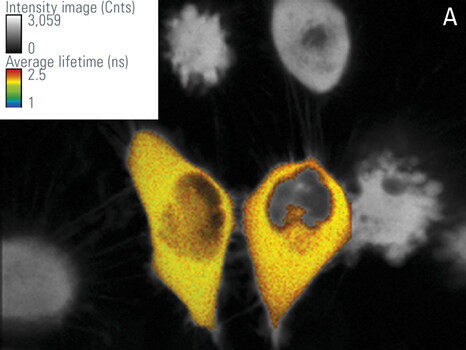
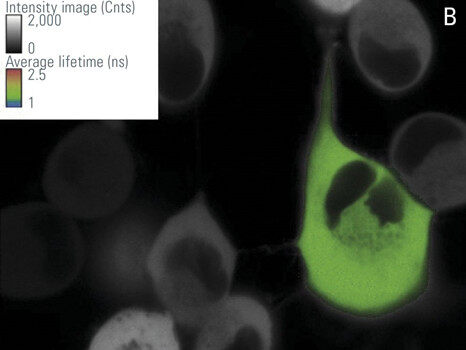
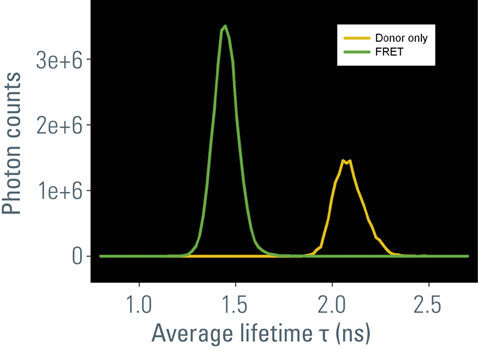
在该工作中,我们使用由CFP-YFP融合蛋白组成的FRET构建体瞬时转染的培养RBKB78细胞(图7)。两个荧光蛋白由两个氨基酸的短连接物连接[1]。这种供体-受体融合也可以作为真实场景中FRET的良好阳性对照。“仅供体”样品由仅用CFP转染的相同细胞组成(图7A)。仅供体和FRET样品(图7B)的平均寿命可在快速FLIM模式下计算出近似值。寿命分布直方图表明供体的平均寿命τ为2.1 ns(图8)。FRET结构的供体寿命为1.4 ns。于是测得FRET效率E = 1 – (1.4/2.1) = 33%。
左:图7:仅用CFP供体(A)和CFP-YFP融合(B)转染的RBKB78细胞。使用光谱型FLIM检测器将检测范围设置在445-495 nm之间。对彩色区域进行分析,颜色代表强度调制的荧光寿命。由德国维尔茨堡大学Gregory Harms教授提供。感谢Benedikt Krämer博士(Picoquant,柏林)、Jan-Hendrik Spille和Wiebke Buck对本实验的支持。
右:图8:按平均寿命统计样品中仅供体(黄色)和发生FRET(绿色)的信号的荧光寿命分布。在FRET样品中,寿命明显变短0.7 ns。
FRET与无FRET的比率
众所周知,CFP本身至少有两个寿命组分[2,3]。此外,我们不知道研究中的所有分子是否都经历FRET。为了公正处理这种复杂性,人们需要了解平均寿命以外的信息。我们可以进行双组分拟合,以此得到两个寿命和两个振幅。后者能使我们估算一个寿命与另一个寿命的相对比例。尤其是使用振幅可以估算表现出FRET的组分(结合组分)和不表现出FRET的组分(游离组分)的相对比例。含有较少第二个组分的荧光蛋白,例如EGFP或Sapphire,是此类分析的理想选择。