徕卡共聚焦课堂第7讲:活细胞成像技术知识点
可视化生命分子动力学
理解复杂和/或快速的细胞动力学是探索生物过程的重要一步。因此,当今的生命科学研究越来越关注实时动态过程,如细胞迁移,细胞、器官或整个动物的形态变化以及活体标本的实时生理(例如细胞内离子组分的变化)事件。解决这些挑战性需求的一种方式是采用被统称为活细胞成像的光学方法。活细胞成像可研究活细胞的动态过程,而非提供细胞当前状态的“快照”——它把快照变成了电影。活细胞成像可提供单个细胞、细胞网络(原位)甚至整个生物体(体内)中动态事件的空间和时间信息。这些特点让活细胞成像成为解决细胞生物学、癌症研究、发育生物学和神经科学问题的必要技术。
近年来,电子学、光学和分子生物学都取得了重大进步,科学家们可以很容易地进行活细胞成像。

用于活细胞成像的方法
显微技术在活细胞成像方面的应用也非常广泛。通常,使用复合显微镜和对比方法(例如相差和微分干涉相差(DIC))随着时间观察细胞的生长,细胞聚集或细胞运动。此外,通常使用立体显微镜或宏观镜进行较大样本(例如斑马鱼胚胎发育)的延时成像。在过去数十年中,先进荧光技术变得越来越重要。随着共聚焦显微镜应用的迅速增加,生物研究的视角已由平面转向三维。以下是一些常用技术的简要概述。
离子成像——观察离子浓度的变化
一种常用的方法是使用荧光染料或特别设计的蛋白质来改变其在钙结合时的发射行为的离子成像(钙、氯、镁)。这使得研究人员可以观察到细胞离子浓度的动态变化。由于细胞胞质溶胶中的离子组成决定了细胞的很多重要功能,如神经元的兴奋性、基因转录和细胞运动(仅举几例),细胞内离子在空间和时间上的调节是生物学研究的主要兴趣。此外,使用特殊的荧光染料可以对细胞内的pH值或电压进行成像。一种用来对离子水平、pH值或电压变化进行成像的特殊技术是比率成像法。这些方法能够精确确定细胞内钙浓度等信息,而非像非比率方法那样监测相对变化。
FRET – 量化蛋白质-蛋白质相互作用
要检测动态蛋白质相互作用,可以在活细胞实验中对FRET(荧光共振能量转移)和BRET(生物发光共振能量转移)事件进行成像。FRET是量化分子动力学的有利工具,如蛋白质-蛋白质相互作用、蛋白质-DNA相互作用和蛋白质构象变化等。FRET成像通常使用GFP(绿色荧光蛋白)的衍生物,尤其是CFP和YFP(分别为青色和黄色荧光蛋白),它们各自使用分子生物学方法连接到感兴趣的目的蛋白质上。然后用荧光激发CFP分子。一旦目的蛋白质在空间上接近(<20 nm),CFP将作为供体并以光的形式发射能量转移给作为受体的YFP。研究人员将观察到从CFP发出的蓝色荧光转变为从YFP发出的黄色荧光。使用BRET时,供体是生物发光分子(例如荧光素酶衍生物),与FRET一样,GFP衍生物作为受体。

图1:拟南芥的共聚焦活细胞图像;内质网:GFP标记为绿色,自发荧光叶绿体为红色,透射光为蓝色。基于这样的图像,可以完成FRET或FRAP等分析。
FRAP–监测蛋白质和囊泡转运
光漂白后荧光恢复(FRAP)是一种常用的监测蛋白质或囊泡转运的方法。荧光蛋白(通常是GFP)附着在目的蛋白质上(即要监测此蛋白质的运动)。通常情况下,整个细胞最初发出荧光,因为整个细胞中可能含有丰富的蛋白质。然后细胞的某个区域,通常是神经元细胞中的细胞突起,如轴突或树突,暴露在高强度的光下(通常是激光),该特定区域的荧光被破坏(漂白)。随着目的蛋白质的移动,来自细胞其他区域的蛋白质会以一定的速度重新侵入漂白区域,然后漂白区域的荧光恢复。这能让研究人员深入了解胞内运输动力学。
TIRF–观察靠近细胞膜的生物进程
TIRF(全内反射)显微镜是一种特殊技术,用于观察位于或靠近细胞质膜的事件。TIRF显微镜使用仅穿透细胞60-250 nm的瞬逝场进行荧光染料激发,可提供出色的z分辨率,从而能对质膜中或附近发生的事件进行成像(例如分子运输至质膜),而不会被细胞内分子发出的荧光所掩盖。
TIRF图像:靠近膜的Galectin-3(半乳糖凝集素3)囊泡沿肌动蛋白丝的运输。
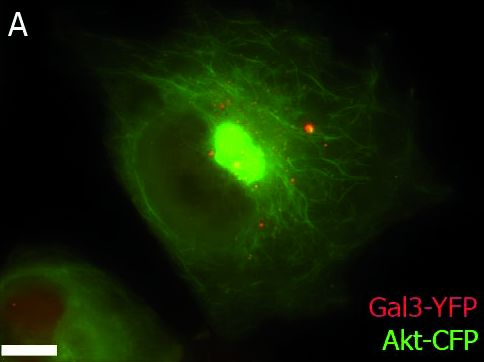
图2A:落射荧光概览图像
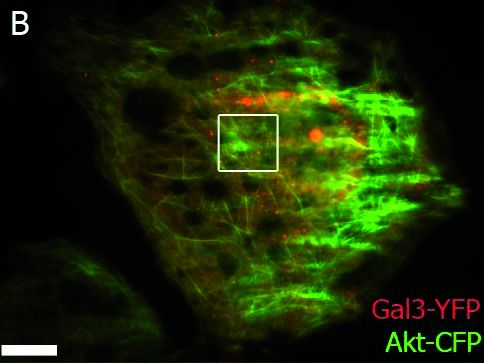
图2B:TIRF概览图像,框选部分如C所示

图2C:TIRF截面的时间序列;时间以秒为单位。靠近膜(箭头)的Galectin-3囊泡(用YFP标记)首先沿着肌动蛋白丝(从底部向上)运输,转移到另一条肌动蛋白丝(88秒),向左移动(109秒),再向右运输,再次转换肌动蛋白丝,然后向上运输(246秒)。
YFP:红色;CFP:绿色;概览图像的标尺:20 µm;截面:6 µm;TIRF穿透深度:110 nm。由德国马尔堡大学的Ralf Jacob提供
光活化——监测基因表达和蛋白质转运
最近开发的一种被称为光活化的方法能够选择性地标记细胞或整个生物体内的特定区域或感兴趣区域。进行光活化时,使用专门设计的染料或荧光蛋白,如光活化绿色荧光蛋白(paGFP)或Kaede。这些荧光团在正常状态下不发荧光。但在用特定波长的光照射后,它们可以像传统荧光团一样被激活,发出荧光。在很多情况下,将这些蛋白质与某些目的蛋白质进行基因融合,可以监测其表达或转运。然后可以应用FRAP或粒子跟踪等方法来进一步研究目的蛋白质。
MPE–深入研究进程
在细胞培养实验中,现代生物学研究需要真正的体内研究来补充“类似体内”研究。但很难研究像老鼠这样的生物体内发生的过程。多光子激发(MPE)显微镜能够更深入地穿透组织,因为与用于单光子激发的短波长光相比,近红外激发光具有更长的波长,散射更少。MPE技术的非线性特性将光漂白和光毒性限制在焦点区域。这对长期研究非常有益,因为荧光蛋白和生物体都受到这些问题的困扰。据报告,使用合适的标本和显微镜设置,成像深度可以深入组织中数毫米。激发的精确定位使其也适用于光子操纵。该方法在神经生物学中得到了广泛的应用。
STED——纳米级的细胞动力学研究
受激发射损耗(STED)显微镜使科学家能够研究超出光学分辨率极限的结构。该技术利用荧光染料的特性,受激发射,以消除可检测的信号。目前已成功成像50-70 nm的细胞内结构。提高分辨率对于研究小的细胞内结构非常重要。尤其是对于想研究共定位事件的人来说,提高分辨率可以产生更真实的结果。与其他超分辨率技术相比,STED的随机独立性能够实现极为快速的成像。已实现视频速率STED采集,可以实时研究细胞动力学。

图3:使用snap-tag技术的STED活细胞成像:Vero细胞,结构:EB3,瞬时转染;标签:Oregon Green 488。
FLIM–活细胞的空间测量
荧光寿命成像的优点是数据不依赖于信号强度。因此不受光漂白和浓度变化等常见伪影的影响。使用时间相关的单光子计数,通过单分子检测数据重建FLIM图像。可以记录和分析亚纳秒荧光寿命的最小变化。该方法可用于研究导致荧光寿命改变的任何类型的细胞外和细胞内环境改变。基于FLIM的FRET分析对发射强度不敏感,从而提高了定量数据的精度。
CARS和SRS – 使用振动对比的无标记方法
几乎所有的活细胞荧光成像方法都基于荧光蛋白的基因表达。这涉及到大量的技术工作和高昂的费用。此外,外部基因的表达可能会改变微环境,从而导致数据与实际生理学情况的差异。相干反斯托克斯拉曼散射(CARS)显微镜和受激拉曼散射(SRS)显微镜是不依赖于荧光染料的非线性共聚焦方法。这些无标记方法可对样品中特定化学键的振动状态进行成像。生物体中特定化学键的积累,例如轴突周围髓鞘中的脂质,可以在无需染色的情况下以高分辨率和出色的信噪比质量进行成像。
未来属于定量分析
生物学研究已经脱离了描述性研究的时代,进入了定量分析的时代。新的活细胞成像技术在空间和时间上都朝着分辨率更高的方向发展。目前的技术发展主要是在纳米范围内对单个分子和短至几皮秒的分子反应进行定量研究。