徕卡共聚焦课堂第10讲:无标记荧光寿命成像
生理学条件下的显微镜成像
很多生物样品都会产生自发荧光。它的光谱往往很宽,会干扰荧光标记。本应用指南论述了自发荧光如何作为荧光寿命成像显微镜(FLIM)中的内在对比度,从而产生多色图像。此外还概述了如何将光谱成像与荧光寿命信息相结合,以区分进而识别生物样品中的不同荧光组分。

显微镜遇见自发荧光
在荧光显微镜观察中,自发荧光通常被视为很多生物样品固有的瑕疵。它往往与内源性荧光信号的光谱相重叠,且有时会掩盖其信号。它可能会导致光谱拆分和荧光强度比率分析定量的困难。自发荧光通常具有极宽的发射光谱,这使它在普通的光谱成像中拆分起来非常困难。
但自发荧光本身也有其优点。它是一种内在的荧光信号,完全自然无需标记。本应用指南旨在通过荧光寿命成像(FLIM)识别几种自发荧光成分,并阐述它们在生物医学研究中的应用
注:有关FLIM技术的基本原理,请参阅应用指南《FRET with Flim - Quantitative in-vivo Biochemistry》
自发荧光遇见生命科学
大多数生物样品含有可引起自发荧光的生化成分。例如,细胞的氧化还原状态反映在其NAD(P)H和flavins的浓度上。前者更适合用IR光源激发,后者也可以用405 nm激发。很多结构蛋白(例如胶原蛋白、弹性蛋白和纤原蛋白)都可以得到其荧光寿命图像。
植物细胞尤其富含大量自发荧光分子。极为常见的有叶绿素、类胡萝卜素、多酚等。通常情况下,这些化合物不仅可以提供无标记自发荧光,还可以提供有关细胞或组织中代谢状态或病理状态的信息。因此,可以通过FLIM和自发荧光结合得出有关细胞功能的结论。
无标记反差
为了说明自发荧光在生物样品中的作用,我们将分别考察动物界和植物界的示例。
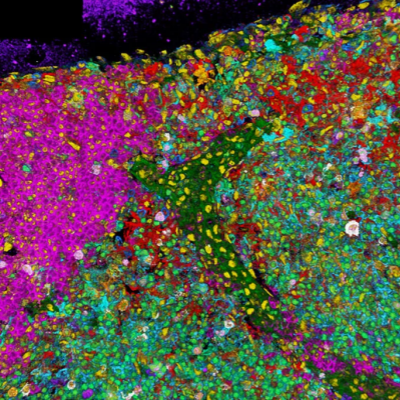
我们先来看介壳虫。收集并立即制作这种寄生虫不同发育阶段的标本。使用10倍物镜记录激发波长为470 nm处自发荧光的概览图像(图1)。荧光强度图像FLIM数据创建,充分呈现了样品的结构。此处的强度是每个像素的光子计数,而非标准强度图像。荧光强度无法区分任何自发荧光种类(图1A)。这些信息包含荧光寿命图(图1B),呈现空间荧光寿命分布,它提供了不同荧光寿命成分的图像。
就自发荧光而言,这通常代表不同的分子种类或其组合。我们可以很好地区分触角和腿周围壳多糖化的外骨骼(绿色到蓝色)。壳多糖的寿命很短。周围组织的荧光寿命比较均一接近3 ns(黄色)。某些具有较长寿命(橙色)的区域可能代表其他物质,但在此处,它们更可能代表较暗的区域,这些区域在荧光寿命的测量精度较低。
通常作为FLIM图像感知和传达的内容实际上是强度调制荧光寿命图(图1C)。荧光寿命信息乘以强度图像。这种再现方式倾向于不强调光子较少统计较差的较暗区域,并且保留了强度图像中包含的更多结构信息。后者通常有助于解释荧光寿命,例如荧光寿命图中的橙色区域。我们可以得出结论,FLIM能让我们在不受干扰的情况下识别不同的分子种类并研究其空间相互关系。

图1:介壳虫的自发荧光图像(腹面观)。强度图像(A)、荧光寿命图(B,去背景) 和强度调制荧光寿命图像(C)。荧光寿命图显示至少三个不同颜色编码不同荧光寿命,并显示空间位置信息。长度为1.5 mm,截面厚度为1.3 μm。扫描格式280 x 512,物镜10x NA 0.4,用470 nm激发,检测478 nm至703 nm的发射(样品由荷兰阿姆斯特丹NCI的Kees Jalink提供)。
深度–三维荧光寿命成像
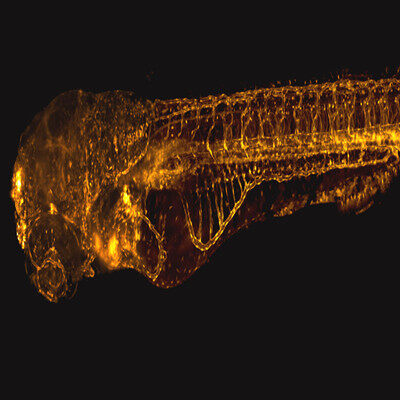
仔细观察自发荧光图像(图1),我们会发现触角外部有蓝色区域,内部有绿色区域。那么,绿色区域是代表不同的成分,还是壳多糖荧光(蓝色编码)和周围组织(黄色编码)的混合?为了解决这个问题,我们可以在较小的区域上使用较高NA的物镜。我们还必须考虑图像的z扩展。为了更好地观察结构的内部,我们可以记录FLIM z-stack(图2)。事实证明,较短的寿命是由壳多糖引起,因为触角内部的荧光寿命与中间切面显示的周围组织荧光寿命相同(图2A,白框)。可以使用z-stack最大投影查看厚的结构(图2B)。等值面渲染促进了对3D切面结构的更充分了解(图3)。请注意,关节不含壳多糖,这在FLIM数据中清晰可见。FLIM图像能看到重要的分类特征,例如散布在所有身体部位的毛状刚毛,它们显然含有壳多糖成分。
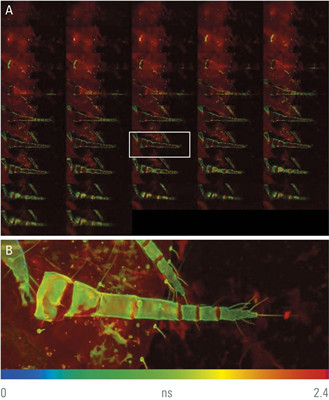
图2:介壳虫触角的FLIM z-stack。使用40x NA 1.25镜头(A)记录了约1 μm深度的40个切面。最大投影显示了触角和一些壳多糖化的毛发(B)。最大投影使用第三方软件完成。视场为388 x 151 μm。
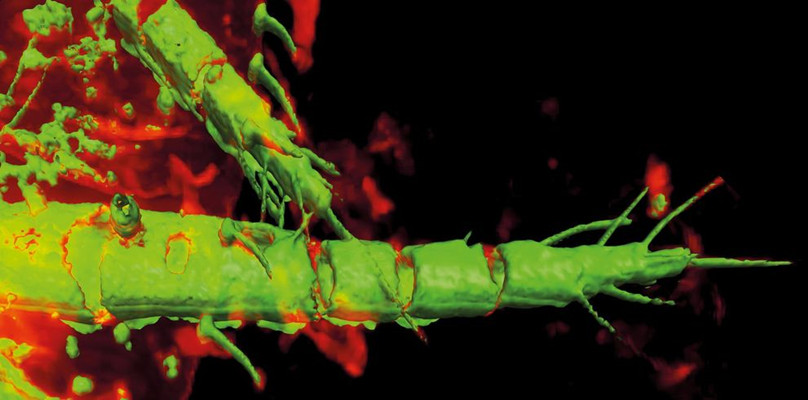
图3:使用图2中显示的层切图像形成触角的3D图像。壳多糖化结构出现在带有阴影的等值面渲染中(绿色)与周围组织的3D图像重叠显示。(3D可视化使用外部软件完成)。
多色自发荧光
植物中的荧光成像通常会受到多种荧光物质的影响,例如叶绿素和多种细胞壁成分以及多种内源性色素。在这里,我们利用这些内在的自发荧光团来显示难以区分的结构。我们记录了从百合花中提取的花粉粒(小孢子)的z-stack荧光寿命图像(图4)。花粉粒的花药具有肉眼可见和透射光(未显示)可见的橙黄色。植物界中此类黄色荧光物质的可能的物质是类胡萝卜素。我们获得了0.5 ns到1.2 ns的荧光寿命。两个主要物质的荧光寿命形成鲜明对比。绿色的是(假定的)管单元的网状外层,它围绕着呈现为蓝色(0.5 ns)的核心。Z切片显示该核心未填充寿命较短的物质,而是在管细胞周围形成薄的内层(图4A)。最大投影图(图4B)和3D可视化图(图4C)有助于清晰显示两个层的相对立体结构。

图4:百合(百合花)的小孢子(花粉粒)。使用470 nm激发的自发荧光揭示了管细胞外层中两种结构不同的荧光物质。使用20x NA 0.7镜头检测从482 nm到744 nm(A)的发射荧光,记录了45个Z轴层面(A)。使用外部软件(B)进行最大投影,并使用外部软件(C)进行3D等值面渲染。孢子的纵向延伸为130 μm。