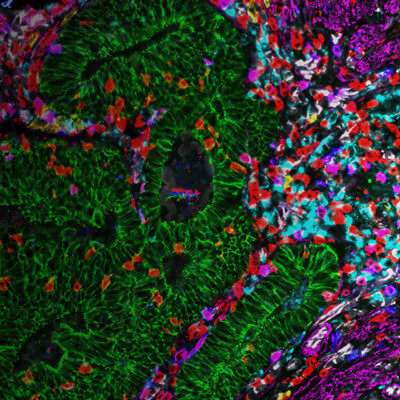
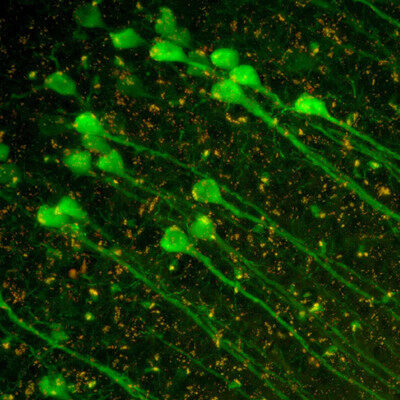
利用徕卡THUNDER成像系统探索微生物肠道免疫机制
由SARS-CoV-2冠状病毒引起的Covid-19影响了世界的方方面面。免疫和治疗方法等抗病毒方向的研究在2020年具有高优先级,显微镜在这类研究中起着举足轻重的作用。了解受体结合、基因组释放、复制、组装和病毒出芽的基本原理及免疫应答,可以使用不同的方法和显微镜。鉴于显微镜在感染生物学中的重要作用,我们举例阐述不同的显微技术及其在这些研究领域中的应用。
研究背景
人类出生后胃肠道立刻被复杂的微生物群落定植(1000余种,且数量>100万亿),而这些肠道微生物群落影响宿主生理的多个方面,包括代谢、免疫反应、行为和昼夜节律等等。先前的研究认为肠道微生物群落主要是共生菌,共生菌可控制病原菌数量,而黏膜屏障免疫对于维持共生菌群和抵抗侵入性细菌感染至关重要。
微生物-肠-脑轴是将大脑和肠道功能整合的双向信息交流系统,并涉及神经、免疫和内分泌机制。除了神经内分泌系统和神经免疫系统之外,该轴还包括了中枢神经系统(CNS)、自主神经系统(ANS)的交感神经和副交感神经分支以及肠道神经系统(ENS)。从肠道到CNS的传入纤维(如大脑、扣带回、小脑扁桃体和扁桃体皮质)以及肠道平滑肌的效应纤维是沿着微生物-肠-脑轴进行双向信息交流的主要途径。

图1 微生物-肠-脑轴
肠道神经系统(ENS)遍布肠道组织的每个角落,将收集到的信息迅速地传递到自体或非自体类型的细胞,织就一个庞大又复杂的网络系统。新涌现的多个研究报道发现ENS可以作为免疫系统的感应平台,但对ENS与上皮细胞的互作机制还知之甚少。
2019年12月,Jarret等人在Cell发表了题为Enteric Nervous System-Derived IL-18 Orchestrates Mucosal Barrier Immunity的文章。借助单分子mRNA荧光原位杂交(smFISH; THUNDER Imager 3D Live Cell),研究发现ENS神经元分泌IL-18作用于肠道上皮细胞中的杯状细胞,促进杯状细胞抗菌蛋白(AMP)的表达,在肠道免疫中起着重要作用。
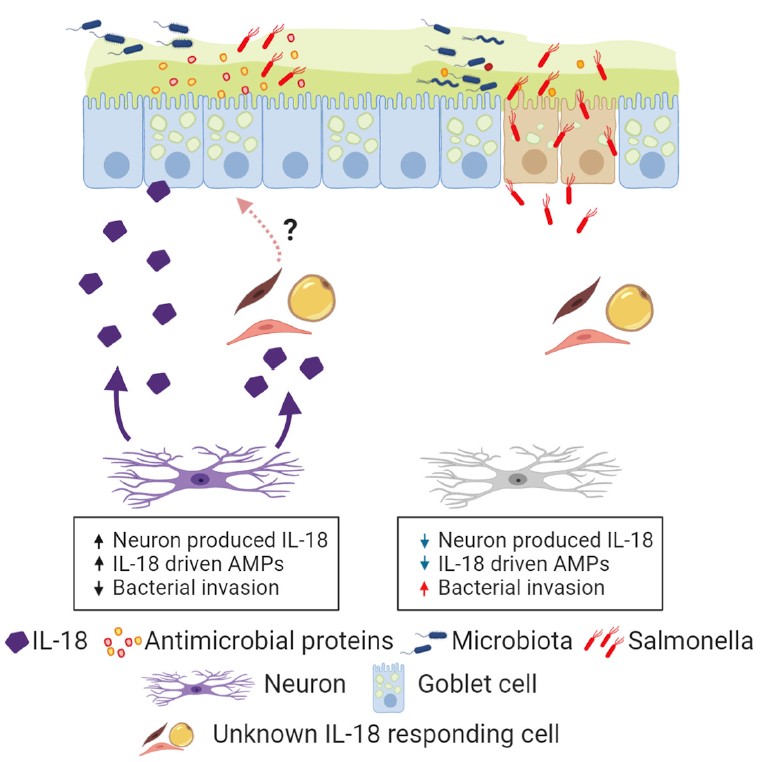
图2 ENS与肠道上皮细胞互作机制
研究过程
鉴于大脑中神经元会分泌IL-18,而大量研究表明ENS可能在调节粘膜屏障免疫中发挥关键作用,因此研究人员大胆猜测肠道神经元也会分泌IL-18。接下来作者构建ENS特异性敲除IL-18小鼠和多种细胞类型特异性敲除IL-18R小鼠,并分别用鼠伤寒沙门氏菌(S.t)感染。之后作者通过共聚焦观察发现不携带ENS所产生的IL-18的小鼠则更容易受到感染。为了证实这一发现,研究人员使用了IL18 mRNA探针在小鼠中进行了单分子mRNA荧光原位杂交(smFISH),结果显示在IL-18-/-小鼠结肠中IL18 mRNA探针的信号丢失。
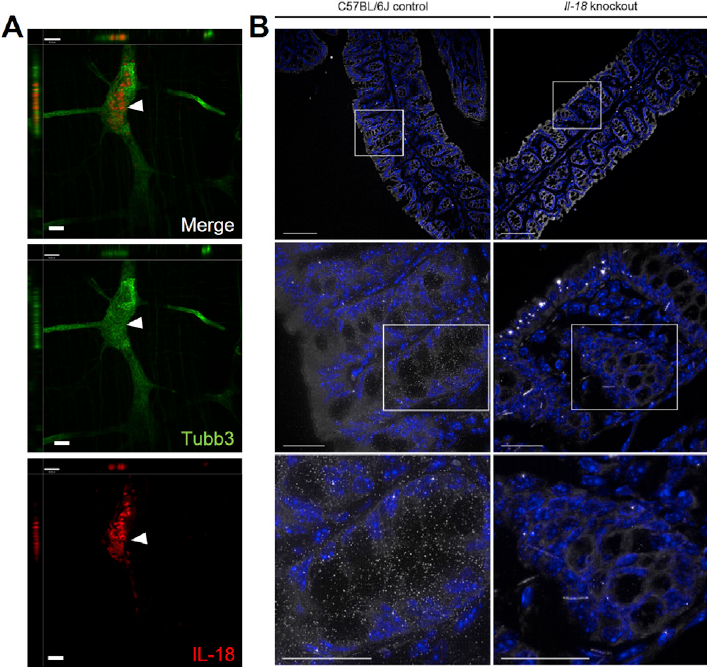
图3 THUNDER验证结果与Confocal观察结果一致
A)用于分析IL-18+神经元的Confocal正交视图。IL-18(红色),Tubb3(绿色)。
B)通过smFISH观察野生型与IL18-/-小鼠结肠中的IL18 mRNA(白色)和DAPI(蓝色)。
同时通过smFISH检测小鼠肠组织中IL18与Tubb3的表达,观察到IL18 mRNA探针与神经元特异性Tubb3 mRNA探针共定位。

图4 smFISH检测小鼠肠组织中IL18(红色)、Tubb3(白色)表达;DAPI(蓝色)表示细胞核
总之,这些数据表明肠神经元是结肠中IL-18的新产生者。研究还结合了单细胞转录组技术来探究ENS来源IL-18的功能以及作用方式。
实验方法
1. 处死小鼠,移出结肠并用冷PBS冲洗。纵向剖开结肠组织平铺于滤纸。
2. 用4%多聚甲醛PBS溶液固定3小时,后置于30%蔗糖、4%PFA的PBS溶液中4℃过夜。
3. 包埋,制成将7mm厚切片,并用于smFISH染色。
4. 设计的探针库与Cy5(IL-18)、TMR(Tubb3)结合,将切片与smFISH探针库杂交。
5. 封片前去除ENS内的自发荧光信号。
6. 在Leica THUNDER Imager 3D Live Cell上进行smFISH成像,使用自带的THUNDER Computational Clearing设置。
看到这里大家可能会有一个疑问:为什么不用共聚焦显微镜做smFISH而是选择徕卡THUNDER?
对,为什么?小编也提出过这个问题,但是下面这段话做出了很好地解释。

smFISH的实验过程中探针会发出大量光子,而共聚焦则会显著限制光子收集的数量,为了最大限度回收这些光子,更建议使用宽场技术。
徕卡THUNDER凭借其高分辨、快速、大视野的特点,可大限度回收实验中smFISH探针发出的大量光子,减少光损耗,更适用于smFISH成像。不仅可以获得清晰锐利的图像,实验结果更便于统计分析且重复性高,是您进行组织大视野快扫的不二之选。
参考文献
1、 Jarret et al., 2020, Cell 180, 50–63
2、 Brain Res. 2018 August 15; 1693(Pt B): 128–133
3、 Jung, Y. J.,et al., 2017, Sci Rep 7(1):17360
4、 Zhang, H., et al. 2018, Synth Syst Biotechnol 3(2): 113-120