徕卡精准空间生物学解决方案 第四弹
Cell DIVE超多标组织成像分析系统

Cell DIVE超多标组织成像分析系统是一种经验证的系统,尽可能保证组织完整度的前提下,通过循环染色成像(染色-成像-漂白)的方法,在单细胞层级对单个组织样本的100多种生物标志物进行成像与分析,从而提供蛋白层面定性和定量的结果。该系统包含:370+经验证的抗体资源库、对组织样品尽可能保护的可定制化设计的染色方案,设计精密的成像系统,和简单易用的采集和分析软件。
Cell DIVE工作流程

方案特点
专利的循环染色成像技术,可在保证组织完整度的前提下,实现一张切片100+生物标志物进行定性和定量分析。
全流程采用商业化的试剂耗材,极大节省成本。
开放性、开源性,可根据实验目的灵活设计实验方案。
兼容性,可兼容已经验证过的抗体。
下游搭配Aivia分析软件,识别、圈选与分割感兴趣的细胞或区域,进行细胞计数、表型分析、空间距离分析等。
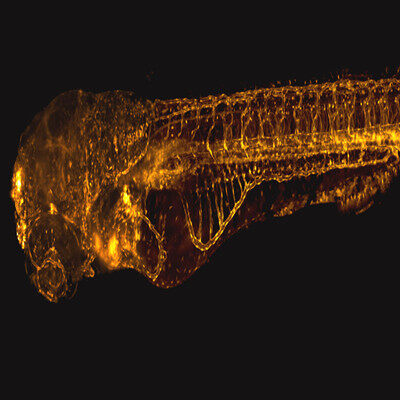
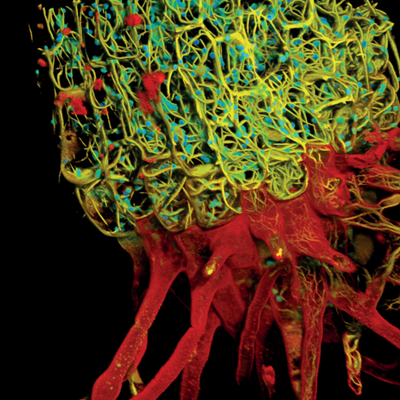
小鼠中脑冠状切片;
13个biomarker成像:Beta-Tubulin,CNPase,FUS,HUD,IBA1,LC3A,MAP2,GFAP,Vimentin,SMA,NEUN,SORLA,DAPI;
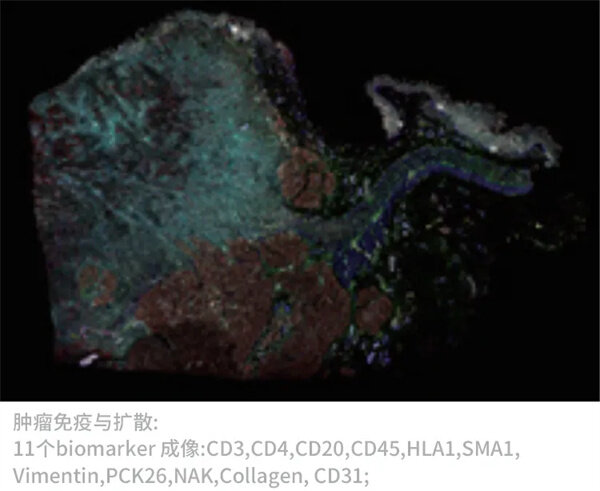
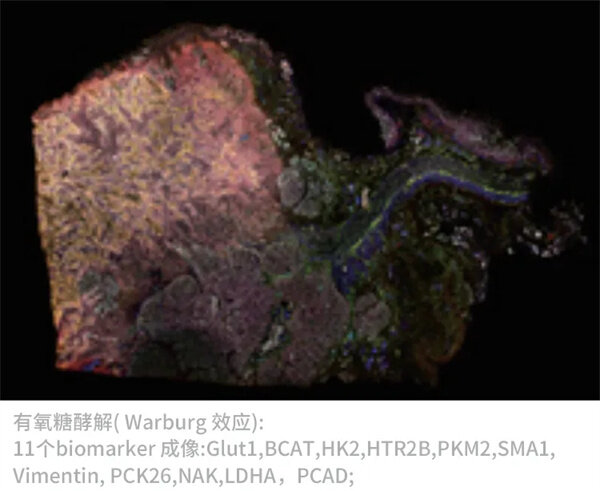
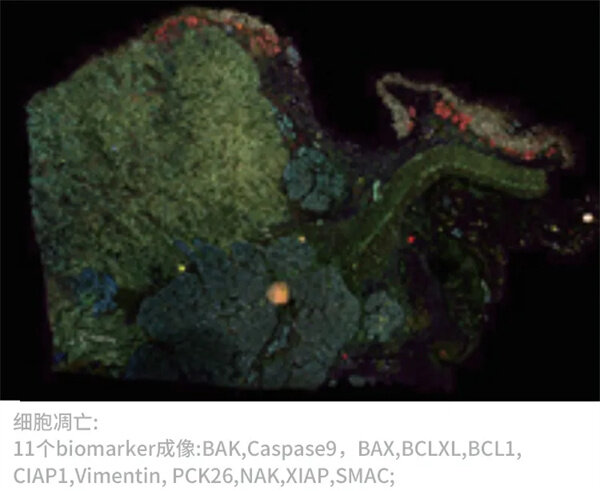
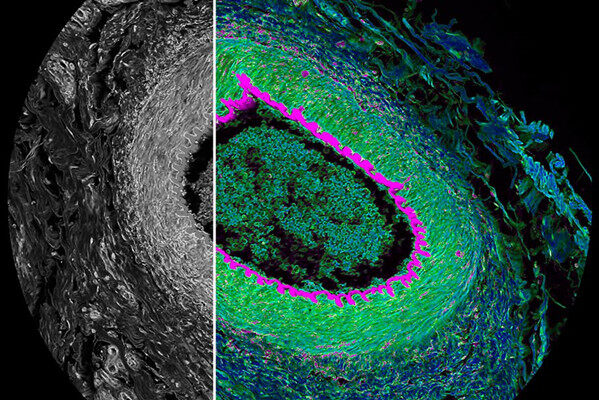
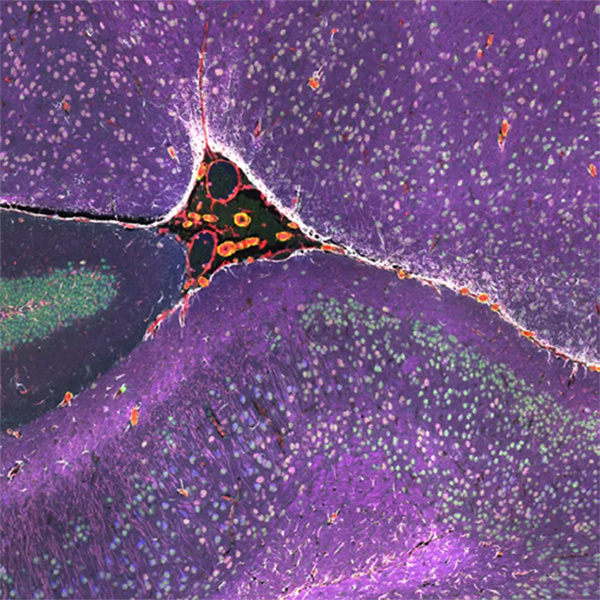
同一张胰腺癌切片上的3组生物标记物成像(27个Biomarker成像,DAPI作为核定位)
科研成果发表(部分)
1.Deep learning-based automated pipeline for blood vessel detection and distribution analysis in multiplexed prostate cancer images. Karageorgos GM, Cho S, McDonough E, Chadwick C, et al. Front. Bioinform. (2024)
2.A single cell atlas of frozen shoulder capsule identifies features associated with inflammatory fibrosis resolution. Ng,M.T.H.,Borst, R.Gacaferi, H. et al. Nat Commun (2024).
3.3D reconstruction of skin and spatial mapping of immune cell density, vascular distance and effects of sun exposure and aging. Ghose, S., Ju, Y., McDonough, E. et al. Commun Biol (2023).
STELLARIS白激光共聚焦平台

STELLARIS 是一款创新设计的激光共聚焦成像系统,它通过整合白光激光(WLL)、声光分光器(AOBS),Power HyD 检测器,及荧光寿命模块TauSense大大地增强了荧光成像的灵活性和质量。
技术原理
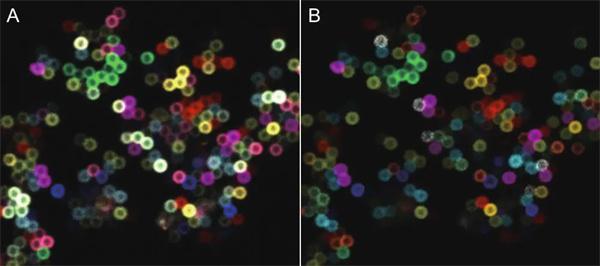
(A)11色微珠(名义直径0.8微米)样本的原始图像,以及(B)使用STELLARIS集成的染料分离工具获得的图像。AF 405(蓝色),AF 532(灰色),AF 594(橙色),AF 750(青色),AF 488(浅绿色),AF 555(黄色),AF 647(洋红色),AF 790(红色),AF 514(绿色),AF 568(紫色),AF700(浅黄色)。
白激光:随着生物研究对同时观察多重事件的需求日增,传统共聚焦显微技术在多色标记实验中面临光谱重叠引起的限制。STELLARIS 白激光的高度可调性能够精确匹配样本染料的光谱特性,优化了多色实验的清晰度与精确度,可以通过单次成像实现11色,并且没有串色的干扰,突破传统固定激光器在多色成像上的限制。
荧光寿命:传统荧光成像受限于荧光类型和光谱范围,而STELLARIS共聚焦平台可升级荧光寿命技术,通过记录分子在激发态停留的平均时间,来区分微环境中不同的组成部分。荧光寿命与荧光物质的自身结构和所处的微环境(如极性、粘度等)有关,而与激发光强度、荧光团浓度等因素无关,是一种非常好的技术来探究肿瘤微环境中的pH值、离子浓度等。通过结合荧光寿命的维度,帮助科研工作者产生更多的新洞见。
方案特点
激发光谱自由,谱线连续可调,适用各种染料。
来自整个光谱的单一激发谱线,谱线间快速切换。
无串色干扰,多标记一次成像。
通过荧光寿命,分离激发光谱重叠的标记。
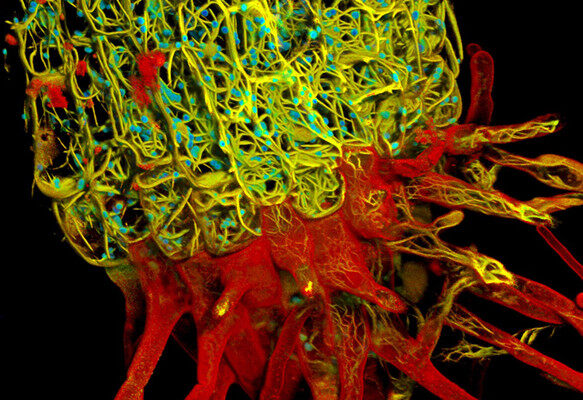
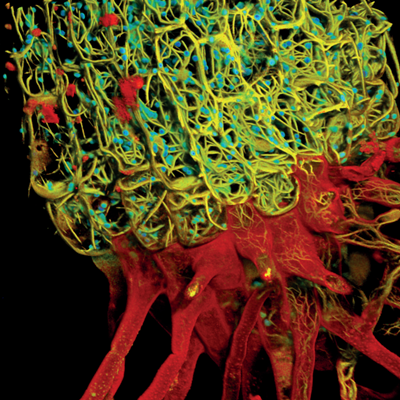
应用案例
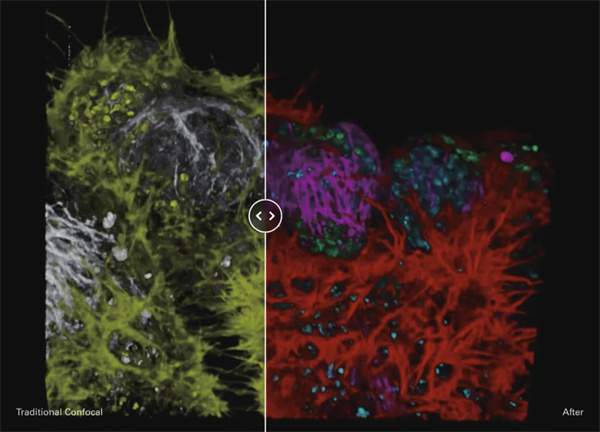
基于荧光寿命的活体NE-115细胞多色成像。
肌动蛋白:LifeAct-mNeonGreen(左图:黄色,右图:红色);线粒体:MitoTracker Green(左图:黄色,右图:绿色);细胞核:NUC Red(左图:灰色,右图:蓝色);和微管蛋白:SiR-tubulin(左图:灰色,右图:洋红色)。
科研成果发表(部分)
1.LRRK2 is required for CD38-mediated NAADP-Ca(2+) signaling and the downstream activation of TFEB (transcription factor EB) inimmune cells. Nabar NR, Heijjer CN, Shi CS, Hwang IY, Ganesan S, Karlsson MCI, Kehrl JH. Autophagy. (2022)
2.Phosphatidic acid suppresses autophagy through competitive inhibition by binding GAPC (glyceraldehyde-3-phosphate dehydrogenase)and PGK (phosphoglycerate kinase) proteins. Guan B, Jiang YT, Lin DL, Lin WH, Xue HW. Autophagy. (2022)
3.Molecular sensors reveal the mechano-chemical response of Phytophthora infestans walls and membranes to mechanical andchemical stress. Michels L, Bronkhorst J, Kasteel M, de Jong D, Albada B, Ketelaar T, Govers F, Sprakel J. Cell Surf. (2022)
4.PICASSO allows ultra-multiplexed uorescence imaging of spatially overlapping proteins without reference spectra measurements.Seo, J., et al., Nat. Comm., (2022).
5.IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Radtke, A.J. et al., PNAS. (2020).
LMD激光显微切割系统

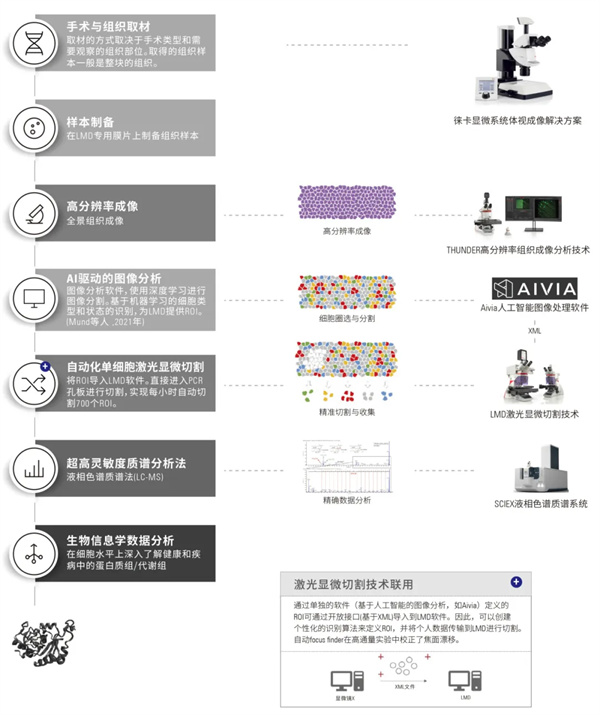
激光显微切割(Laser Microdissection,LMD)是一种适用于精确制备样品的技术。在许多研究领域,它是获得纯净的、单一的后续实验起始材料的先决条件。在基因组学、转录组学、蛋白质组学、代谢组学、微阵列、二代测序、生物芯片等领域中,需要使用这项高精度技术以进行有意义的分析。
LMD技术流程
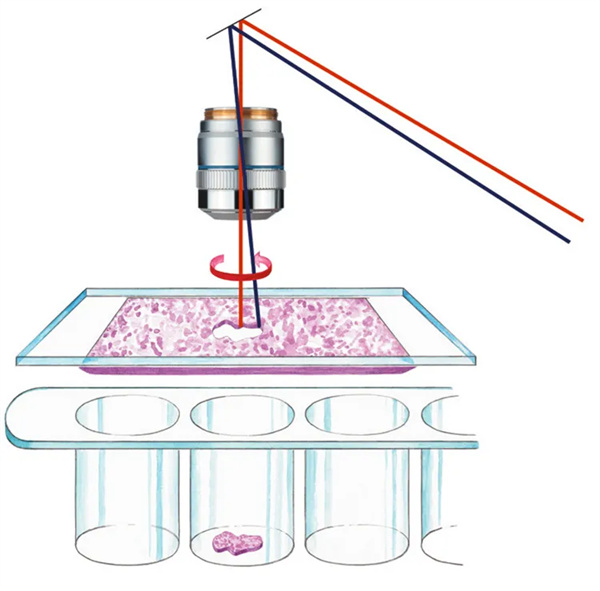
第一步
界定观察与切割区域
第二步
棱镜沿着设定的界限精确地引导激光束
第三步
借助重力来采集切割物
方案特点
重力收集,无污染无接触的收集方式。
激光束移动,切割精度高(0.07um),满足高倍物镜下切割要求如单细胞,甚至染色体切割。
高通量收集,适配96/384/1536孔等不同通量的多孔板,保证单细胞收集高效又便捷。
基于正置显微镜,从THUNDER高分辨率成像到精确收集,可以在同一台THUNDER-LMD一体机实现,减少组织转移的风险。
联用Aivia分析软件,识别与圈选感兴趣的细胞或区域。
实验流程(深度视觉蛋白质组学)