在显微成像和图像分析中运用人工智能和机器学习技术
采访 Emma Lundberg 教授
徕卡显微系统公司有机会与 Lundberg 教授探讨了运用人工智能 (AI) 和机器学习技术进行显微图像分析。她在实验室开发的人工智能和机器学习模型有助于改进图像采集以及随后的处理和分析。例如,与使用传统的分析方法相比,科学家们可以采用更高效的方法识别细胞和蛋白质。此外,人工智能对于图像分割也非常有用,图像分割可帮助科学家获得更好的定量数据并进行可靠的统计分析,并且在成像过程中进行几乎实时的分析以便检查动态细胞事件。这些模型还可以利用特定格式的空间信息,这些格式可与蛋白质组学数据或单细胞测序数据等其他类型数据轻松整合。详情请阅读以下采访。
您能否给我们介绍一下您目前的研究工作?
Lundberg 教授:我是人类蛋白质细胞图谱(HPA)项目的总监,该项目涉及绘制人类细胞中的蛋白质分布图。在这个大型项目中,我们生成了许多高分辨率共聚焦图像,目的是解释蛋白质在细胞中的模式和分布。这项工作相当重要,因为大约一半的人蛋白存在于两个或多个细胞区室中,因此通常是两种不同模式的混合。我们还研究数十种不同的细胞系,这些细胞系具有不同的形态,呈现细胞器的方式也略有不同。在启动该项目时,我们手动进行所有标注,然后逐渐建立机器学习模型,对蛋白质分布模式进行分类。
您的研究工作如何在显微成像中运用人工智能和机器学习技术?它能带来哪些优势?
Lundberg教授: 使用机器学习模型可以节省大量时间,但是我相信真正的成功将取决于我们开发的模型能够将空间信息嵌入到一种格式中,将其与其他类型的分子测量数据整合,例如蛋白质组学数据或单细胞测序数据。机器学习算法的另一个主要优点是进行更加无偏性的图像分析。例如,它可以帮助我们仅凭外观就找到非常相似的细胞,或者我们可以通过异常检测来发现罕见的细胞。
在 HPA 项目中,我们绘制了大多数人类蛋白质的亚细胞分布图,现在,我们开始研究那些在邻近细胞之间的分布上容易发生变化的时间动力学和蛋白质。为此,我们需要能够在单细胞水平上量化空间模式的可靠模型,帮助我们了解细胞形态的细微变化。生物过程由某些蛋白质的相互作用驱动,而且微小的空间重排可能有非常显著的功能性后果,因此我们希望能够识别并量化这些细微的差异。
在实时图像分析方面,我希望新的显微镜可以扩大我们的视野,例如帮助我们预测细胞的周期位置,或者哪些细胞将进入凋亡阶段,或者从明视场图像预测细胞膜标签和 DAPI 染色,以便能将所有这些增强特性实时添加到显微镜视图中。我希望我们最终也会在数据驱动的图像采集与人工智能驱动的图像分析之间形成某种闭环。
能否请您再介绍一下,在采集图像的同时能够分析数据有何好处?
Lundberg 教授:在 HPA 项目中,我们有时会检查罕见事件,例如特定的酶易位到罕见细胞的细胞核中,而它们的功能未知。当我们检查细胞中的这些罕见的空间重新排列时,需要在成像过程中进行近实时的分析。这样,我们可以根据事件具体调整图像,尤其在研究动态事件时。进行频繁的延时成像时,通过这种方法还可以进行稀疏成像以避免光毒性,而当我们探测到要研究的罕见事件时,我们可以选择性地对该细胞成像。
相反,如果我们采用手动分析图像的方法来分析这些罕见事件,就必须停止实验、进行分析,然后重复实验。
既然你们是自己开发这些技术,那么你们是否利用这些技术获得实时结果呢?
Lundberg 教授:我们有一些可以实时运行的轻量级模型。不过,我们尚未实现闭环,也没有完成整合,但是我们希望在不久的将来实现这一目标。例如,我们开发了一种能够从明视场图像预测细胞膜染色的模型,通过该模型,我们能够实现细胞的高精度实时分割。这意味着我们可以在显微成像过程中实时测量分割后细胞中的荧光。
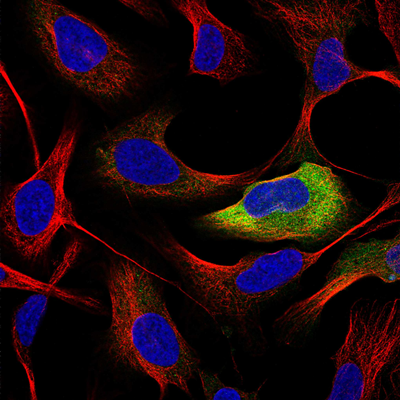
图像来源(人类细胞):人类蛋白质图谱 (https://www.proteinatlas.org/ENSG00000134057-CCNB1/cell#img)
人工智能和机器学习技术可以为日常显微成像工作带来的主要价值是什么?
Lundberg 教授:人工智能驱动的分析可以优化和简化显微图像处理,可以改善信噪比、将图像去卷积或大幅度增高分辨率。它在提高图像质量方面具有巨大的潜力,彻底改变了显微成像领域。
在分析方面,机器学习算法可以为分析大型数据集创造全新的机会。使用现代显微成像技术,我们可以生成非常大的显微镜数据集,而人工智能辅助分析则使我们能够高效、准确地分析这些数据。
此外,我认为在成像方面,人工智能对图像分析中常用的分割方法非常有用。良好的分割非常有帮助,能让用户获得更好的定量数据,进行可靠的统计分析。人工智能驱动并不总那么困难,它可以包括从细胞分割等一般模型到高级算法的各种方法。大多数生物学家很可能会发现机器学习算法在图像分析中非常有用,没有理由不去尝试一下。
无需处理超大型图像数据集的研究人员也能受益于人工智能辅助分析吗?
Lundberg 教授:当然可以。我认为细胞分割将是他们肯定能从中受益的可用工具之一。机器学习算法还可在模式识别方面提供很大帮助,例如用于识别无标志物的特定细胞器。
未来,机器学习模型可用于挖掘开放的图像存储库。此外,它还使我们有机会根据现有数据分析我们自己的成像数据。例如,即使您生成小型数据集,也可以看到您的表型是否与数据库中的另一个表型匹配。
目前,将人工智能应用于显微成像的图像分析是否存在挑战?
Lundberg 教授:是的,当然存在。有多种挑战:共享和管理海量的图像数据集,满足用于训练人工智能模型的计算需求,以及为不习惯使用人工智能模型的研究人员开发易于使用的界面。可能会有许多障碍,具体要看专业领域。人工智能专家很可能希望开发更好的模型,而不习惯使用人工智能模型的显微镜工作者可能想要了解如何使用它们。我认为在机器学习算法的使用上有许多方面可以改进。
您认为是否有研究人员抗拒采用人工智能辅助分析?
Lundberg 教授:总的来说,我认为影像学界已很好地接受了基于人工智能的工具。我认为有些阻力是正常的,因为出现新的分析工具时总会出现这种情况。人工智能辅助图像分割等迭代工具能够让用户在手动修正时随时了解最新情况,在训练期间与模型交互,有助于研究人员对模型充满信心,因为他们可以看到模型如何逐渐改进。但是,用户当然必须认识到模型要进行数据训练,如果输入了错误数据,模型就可能会提供不可靠的输出结果。当然,也不应该盲目相信人工智能驱动的分析。
您是否认为监督式机器学习可以降低对人工智能辅助图像分析法的接受障碍?
Lundberg 教授:当然可以。通常,监督式机器学习需要对数据进行某种标注,而这是我们在成像中已经习惯的事情。例如,当用户想在组织病理学载玻片中标记细胞或标记出感兴趣区域时——这种实况数据的生成经常会形成瓶颈。只要掌握了数量足够的真实情况数据,就可以训练出良好的人工智能模型,但仍需要依靠专家来生成这种实况数据。真实情况的质量反过来又会决定模型的质量。我相信,如果实现这个循环并进行迭代分析,我们可以在专家的指导下训练出更好的模型,改善模型的薄弱环节。这也是一种进步,能够帮助真正的生物学专家增加对模型的信心,他们可以看到模型如何渐渐得到改进。这种“人在回路”方法是一种意义重大的进步。
您认为图像分析的未来会如何?
Lundberg 教授:我认为人工智能模型将真正帮助我们理解和挖掘图像数据的所有丰富内涵。此外,人工智能还可以帮助我们更智能地制定图像采集方案,使我们收集到更好的数据。人工智能工具将帮助我们超解析、还原和处理图像,从而生成更快、更智能、更高质量的数据,并且为解释图像数据和根据图像数据做出预测等提供新的可能性。
我们还需要克服哪些限制,才能使计算分析方法被广泛接受?
Lundberg 教授:我认为一个很大的限制是缺乏免费的公共开放图像存储库,以及用于共享显微成像人工智能模型的模型库。如果我们可以共享所有针对显微成像开发的人工智能模型,并且可以获取所有已采集的图像,那么您就可以训练所有类型的模型,可以研究各种科学问题!
您会对研究人员说些什么来让他们感兴趣并考虑使用人工智能驱动的分析?
Lundberg 教授:现在的时机很合适——市场上有许多很好的工具,即使不是专家,也可以学习如何使用它们。没有理由不接受人工智能驱动的分析方法,因为它可以提供更好的图像和更好的图像分析。大多数显微镜工作者在计划和设置实验上投入大量时间。那么,为什么不同样花一些时间采用这种新技术来改进分析呢?
如果想了解人工智能驱动的图像分析,有一个非常友好、很有帮助的社群。此外,还有许多关于这个方面的开源工具和论坛,所以没有理由不去尝试一下。
目前,在 HPA 数据库中,我们每年拥有大约 1000 万张图像和 120 多万用户。到目前为止,我们只允许用户从我们这里下载数据。也许,在未来的某个时候,我们能允许用户上传自己的图像数据,并且除了文字外还能通过图像查询我们的数据库。这是个非常切实的目标,我认为人工智能会带来很多这样的机会。















