多通道活细胞成像注意事项
同时多色成像,确保实验成功
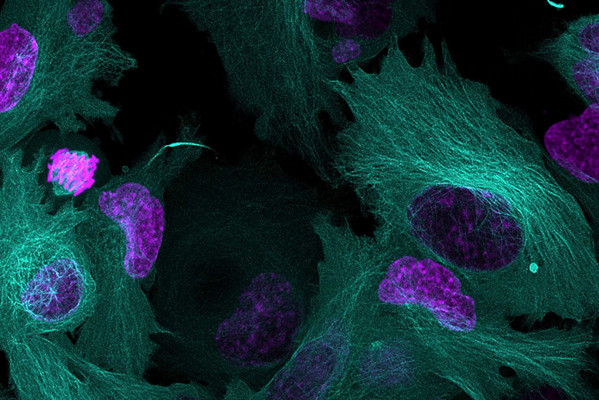
活细胞成像实验是了解动态过程的关键。这类实验使我们能够观察记录活体状态下的细胞,而不会可能因固定或终止不同活体过程而产生干扰性伪影。
通过活细胞成像可以观察细胞、组织或整个生物体在其自然环境中的动态过程,而不仅仅是获得终点图像和数据。例如,您可以研究细胞或蛋白质的共定位,以查看不同的靶点是否彼此相邻,并观察它们如何相互作用。
为什么使用多个荧光标记很重要?
在活细胞显微成像中使用多通道方法可以同步观察多个细胞结构和过程,提供生理学方面更重要的结果,从而为测量数据增加相关信息。通过这种方法可以研究细胞与蛋白质相互作用、动态变化以及这些变化如何相互作用和影响。不过,使用单个荧光团的实验很常见,而使用两个或多个荧光探针对活细胞成像可能会很复杂,并且必须仔细考虑几个要点才能成功。本文将介绍有关成功设置多色活细胞实验的一些关键方面。
选择合适的荧光团
设置多色活细胞实验时,首先要选择合适的荧光团,这一点至关重要。荧光团必须与活体样本相容,并具有光稳定性,才能进行长期成像。荧光蛋白标记、活细胞染料、动态标记(如 Ca2+ 指示剂)及其他用于标记感兴趣靶标的方法是达到这类目的的合适工具。但是,由于发射光谱宽,以多通道方式研究活细胞过程时可供选择的荧光染料仍然相当有限。每使用一个额外的标签,找到具有高特异性和高信号输出的激发/探测模式就变得更加困难。将两个或多个荧光团信号一起成像时,需要使用复杂的标记策略最大程度减少光谱重叠。
在生理条件下成像
无论使用细胞培养物、类器官、球状体还是较小的模式生物,都必须使用近生理条件来确保样本保持活力。在延时实验中,某些条件必须保持最佳状态,才能确保细胞不仅能够存活,而且不会承受压力,并保持真实的生理机能。通常情况下使用培养箱(37°C、二氧化碳、湿度,有时还包括在一段时间内具有高稳定性的氧气)确保持续提供近生理条件。此外,选择一种低自发荧光、不会干扰信号且不影响成像的介质也大有好处。
图像采集注意事项
宽场显微成像通常是活细胞成像的首选,因为它能够更快、更温和地成像。最先进的宽场显微成像使用 LED 光源和滤光片组。尽管有很多滤光片都可以用于各种不同的荧光团组合,但是为了获得用多个荧光团标记的样本的正确图像,需要考虑多个因素。
大多数用于活细胞成像的荧光团都具有宽发射光谱。这一事实通常意味着各个探测通道之间会出现串扰现象,例如,您会在红色探测通道中看到来自绿色通道的一些发射光。在活细胞成像实验中使用多个标记时,荧光光谱重叠现象很常见,因此为了确保看到想识别的细节,可以使用窄带滤光片。但是,这种方法会导致灵敏度下降并影响结果,因为活细胞中的荧光团信号水平通常较低,尤其是对于靶标丰度稀疏的样本或以内源性水平表达的样本。使用更多激发光来抵消灵敏度下降通常不可行,因为这种方法对样本的危害性会增加(即光毒性增加)。
在活细胞实验中,高速采集通常至关重要,特别是在研究快速动态过程时,如囊泡 观察。 使用滤光片会导致速度受限,因为在改变每种颜色的滤光片组时必须依次成像。按顺序采集图像比同时采集图像需要更多时间,因此在采集过程中可能会错过样本的快速运动,因为从一个图像到下一个图像时每种颜色都有更长的时间间隔。 此外,当 两种或多种颜色之间的直接比较 至关重要时,例如在 上述 囊泡 观察 实验中: 信号 甚至可能 在两次 荧光团 采集之间已经移动, 从而加大数据解释的难度。
改善活细胞成像的替代方案
研究活细胞中多个探针之间的相互作用而获得的大量信息可提供生理学方面更重要的结果,因此人们开发了多种方法来拆分复杂的混合发射光信号。
为了能够使用多个标签,以便从一个样本中获得更深入的认识,您可以使用光谱图像信息线性拆分方法,它可以分析每个荧光团对总信号的贡献。要进行线性光谱拆分,必须为所有可能的参考光谱混合方式计算未知光谱与参考光谱之间的最小差值 (1)。这种方法通常用于对多种颜色成像,即使它们重叠。但是在宽场显微成像中,您仍可能遗漏关键信息,因为必须对样本中每个荧光团依次成像,这会导致速度受限。
如果采用其他方法会怎样?
有一种方法可以快速拆分多种颜色,而不必担心采集期间光谱重叠,也无需学习复杂的光谱拆分方法。
最近发表的一些文章介绍了一种基于相量的光谱拆分方法 (2, 3)。光谱相量分析可将每个像素的光谱成分转换为二维图中的一个位置。这样就可以利用简单的数学方法即时、可靠地分离不同染料的发射光。此外,它还可以仅基于光谱而不是强度来增加滤光——从而保留图像的细微细节,同时减少可能会影响线性光谱拆分的噪声。由于实际上消除了串扰以及自发荧光等干扰因素,选择合适的荧光探针组合不再是问题,因此以这种方式成像可以更轻松地设置多通道活细胞成像实验。
参考资料
1.T. Zimmermann,《生物化学工程进展/生物技术》2005, 95, 245
2.F. Fereidouni、A. N. Bader、H. C. Gerritsen《Opt.Express》2012, 20, 12729。
3.Francesco Cutrale、Vikas Trivedi、Le A Trinh、Chi-Li Chiu、John M Choi、Marcela S Artiga 和 Scott E Fraser,高光谱相量分析可实现多通道 5D 体内成像, 《自然·方法学》14, 149–152 (2017) doi:10.1038/nmeth.4134














