FluoSync | 一种快速而温和的多色光谱拆分宽场荧光成像方法
FluoSync是一种使用单次曝光同时进行多通道荧光成像的精简方法。
传统的荧光成像方法通常按顺序对每个通道成像,以减少荧光团之间的串扰。之前已单独介绍了多光谱成像以及后续的线性拆分或基于相量的光谱拆分方法。每一种方法都需要进行繁琐的手动调整或深入理解底层技术,或两者都需要。徕卡显微系统通过FluoSync引入了一种综合方法,在消除复杂性的同时保留了快速温和成像的优点。FluoSync会捕捉整个可见光光谱中的光子,与窄带宽滤光片相比,丢弃的信息更少;然后采用基于相量的混合拆分方法分离每个信号,实现可靠的通道分离。
多通道荧光成像从未如此容易。
多色宽场显微成像
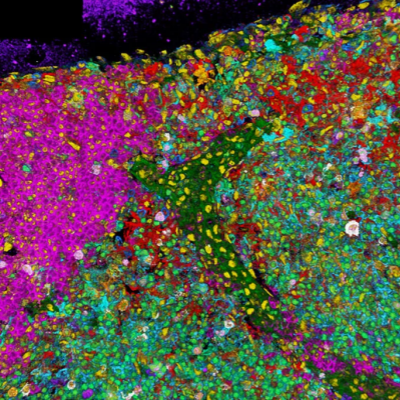
荧光显微成像为研究蛋白质及其他生物分子的细胞功能提供了一种强大的工具。它具有能标记和跟踪高特异性靶分子的独特能力,因此已成为生命科学研究中必不可少的一种工具。抗体和遗传标记可使用光谱可分辨的荧光染料来靶向和标记分子(见图1)。通过组合使用这些荧光标记,用户可以跟踪和研究样本中不同标记的分子群体之间的行为和相互作用。
常见的多色荧光成像方法需要考虑到荧光团信号的光谱重叠,这种现象通常称为串扰或串色,如图1b所示。通常,研究人员可通过将样本中的染料数量保持在最少限度(即最多一种或两种染料)来避免串扰,因为样本中使用的染料越多,发生信号串扰问题的可能性就越大。但是,随着对生物学相关数据需求的日益增长,研究人员需要在一个样本中观察三个或更多事件,因此这种过于简单的方法不再适用。在典型的多通道实验中,通常使用一种或两种荧光染料来识别特定的细胞结构,例如细胞核或线粒体,再使用额外的染料来识别感兴趣的蛋白质。
光谱分离和拆解
在多通道方法中通常需要使用光谱分离良好的染料组合。如图1所示,Alexa 488与Alexa 555的组合就是一个很好的例子,两者分别在光谱的绿色和红色部分发光。但是,在使用多个荧光团染色的样本中,对染料进行光谱分离通常并不容易。染料的发射曲线可能部分重叠,导致一种染料发出的部分荧光信号落入其邻近光谱的探测窗口。换句话说,来自绿色染料的一些信号会串色到红色通道。在活细胞成像中这个问题可能更严重,因为用户为了避免光毒性会尝试避开光谱的蓝色端。研究人员仍然需要使用多种染料来标记感兴趣的蛋白质,但是受限于较窄的光谱区域,这增加了潜在的串扰问题。
有两种常用的方法可对荧光信号进行光谱分解:使用特定的窄带通光学滤色镜和线性拆分(也称为多光谱或高光谱成像)进行分离。
使用特定的窄带通光学滤色镜进行通道分离
最简单的多通道方法是按顺序对染料成像。使用这种方法时,单独激发样本中的每种染料并探测其发射光。激发波长通过激发滤色镜或特定波长的LED进行控制。荧光滤色块中的带通光学滤色镜被移至每个图像的光路中,以检查到达样本和探测器的光谱。最终的复合多色图像是通过叠加单独的曝光而产生的。
按顺序激发染料有助于减少串扰问题,但不能完全将其消除。这种方法可能太慢,无法对快速的细胞事件成像,例如囊泡跟踪或钙成像。通常,感兴趣的对象在两个通道之间移动,因此如果不同时采集两个通道,就无法在两个通道中有效跟踪该对象。此外,对多孔板等大型样本成像时,长采集周期会显著增加实验的运行时间,导致工作效率下降。
为了加快采集过程,可以使用Sedat和Pinkel配置,将多带通荧光滤色块与快速的滤光片轮结合使用。这种小型滤光片轮的切换速度比荧光滤色块快得多。多带通荧光滤色块会阻挡来自窄发射窗口之外的染料的荧光发射,因此可能会丢失宝贵的信号(参见图1a)。该技术还可能增加样本光漂白,并降低最终图像中的时间分辨率和信噪比水平。
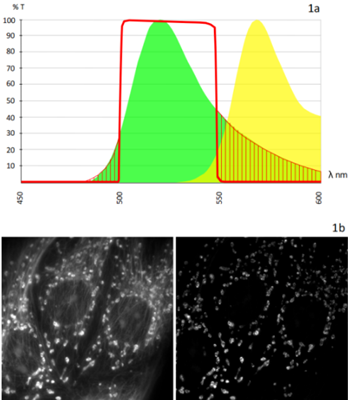
图 1a。Alexa 488(绿色曲线)和Alexa 555(黄色曲线)的荧光发射曲线。两个发射光谱的重叠显而易见。红线表示488发射光滤光镜的带通。只有在这条线下拟合的发射波长才能使其通过滤光镜到达探测器。红色阴影区域显示了488信号的一部分 (~20%) 被滤光镜阻挡,减少与相邻染料发生串扰。
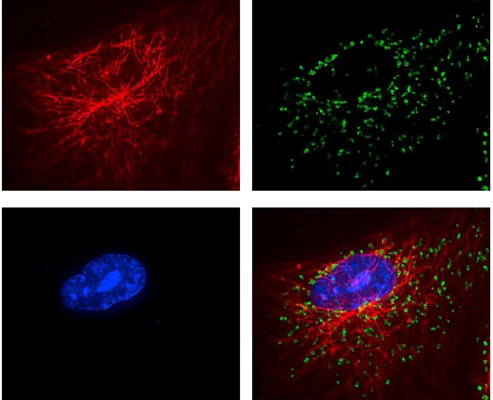
图 1b。图1b中的两张图像分别显示了通道串色(左图),以及使用带通光学滤色镜抑制这种现象(右图)。在这种情况下,对微管染色的红色染料在线粒体图像 中清晰可见,因为图像是使用多带通荧光滤色块采集的,但是探测器前面没有发射光滤光镜。红色染料(微管)与绿色染料(线粒体)交叉激发,导致通道串色严 重。在第二张图像中,使用正确的发射光滤光镜消除了串扰。
线性拆分
另一种分离染料的方法是线性拆分,它使用数学拆分方法来分离通道。在这种方法中,显微镜收集样本的多个图像,每个图像涉及不同的光谱带(参见图 2)。所收集的数据包含每个像素的光谱曲线,以及来自所有荧光团的组合发射光谱。接下来使用光谱线性拆分来量化每一群荧光 团对信号的贡献,然后生成多通道图像。在宽场成像中,该技术称为多光谱成像。在共聚焦成像中,系统通常可以用较高光谱分辨率进行扫描,这种方法称为高光谱成像或兰布达扫描。除非您拥有能够同时捕捉多个光谱窗口的专用硬件,否则这种方法需要对样本反复曝光,导致极端的光胁迫,因此不适合活细胞成像。
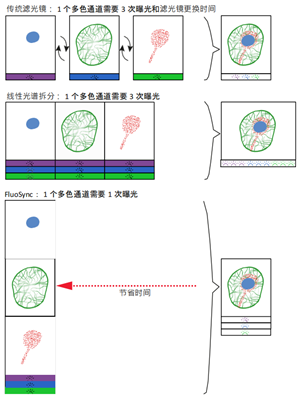
图 2。概括了对含有多种荧光染料的样本成像时的三种颜色分离方法。通过比较发现,与传统荧光成像方法相比,FluoSync采集速度更快的优势显而易见。FluoSync捕捉受激发染料的全发射光谱,因此光子不会被浪费,这使它成为敏感活体样本弱光成像的理想探测技术。
线性拆分要求样本中的每种染料有一个已知的参考光谱。理想情况下,使用相同类型的样本和制备方法采集参考光谱,以便系统能够将染料信号与样本特有的背景噪声和自发荧光区分开。
线性拆分的基础是将校准曲线中的信号水平与从真实样本中采集的数据进行匹配。如果染料浓度不同,即来自一个通道的信号比另一个通道的亮得多,可能会导致拆分误差。此外,如果存在探测器或光学噪声(样本背景荧光),还可能导致引入更多误差来源。这些弱点可能意味着线性拆分不适合光照强度低、背景噪声高的样本以及通道之间强度明显不同的样本。
FluoSync
FluoSync是一种快速、可靠的方法,能拆分来自样本中多个荧光团的信号。它通过相量分析简化了多光谱成像方法(Cutrale 等人, 2017 年),与较为传统的多通道成像方法相比具有多项优势。
FluoSync通过探测器单次曝光同时激发和探测所有通道,从而采集多光谱图像数据。此方法所用的探测器采用多个传感器,每个传感器采集光谱的不同部分。然后,使用基于相量的混合分解方法将产生的组合数据集分解。
由于同时采集所有荧光团,因此它比传统方法的速度更快,成为活细胞成像和微量滴定板等大型样本成像的理想解决方案。动态活细胞的同时成像得益于图像采集的速度和高同步性。在采集来自两个不同荧光团的信号之间,囊泡等快速移动对象不会产生位移。功能实验(例如微量滴定板等较大样本载体上的活细胞/死细胞实验)成像将受益于速度优势,并可将数据与另外的标记物相关联,而不需要额外的采集时间。不同于依靠多个带通荧光滤色块阻挡部分发射信号以改善通道分离的方法,FluoSync使用宽带滤色镜收集大部分发射信号,提供了一种同样适用于弱光成像的高效探测解决方案。收集的光通过内置的光谱分离器进行分离。因此,挑选和安装合适的荧光滤色块已成为历史。
基于相量的光谱拆分
在2008年,Digman等人最初认为基于相量分析的荧光寿命成像(FLIM)是一种进行可视化和快速分析的有效方法。后来,Fereidouni等人和Cutrale等人先后在2012和2017年采用了该方法。根据经验,转换为相量后可将光谱表示在径向颜色轴上,光谱宽度确定了光谱与原点的距离。两种纯染料的混合物会成为纯染料之间的一条直线,而与纯染料的距离代表了对整体信号的相对贡献。适用于任何两种染料的情况也适用于更多染料。每种可能的染料组合最终都会落在相量空间中的指定位置。
通过相量来表示光谱信息,可对图像中的不同荧光组分进行实时、半盲的光谱分解。这种表示方法不仅局限于荧光标记,还可以去除自发荧光等无用信号,因此比线性拆分更加可靠。基于相量的光谱拆分方法最适合用于分解最多3个荧光团的信号。超过3个荧光团时,相量方法仍然可以轻松识别最大的影响因素。
拆分领域的最新发展催生了一种混合拆分方法,它结合了基于相量的拆分和线性拆分这两种方法的优点。
对混合光谱拆分的说明
FluoSync充分利用了基于相量的拆分与线性拆分混合方法的优势。相量分析用于相似光谱的快速聚类以及光谱去噪和线性拆分,能够识别染料对每个聚类的单独贡献,甚至包括超过 3 种染料的情况(图3)。
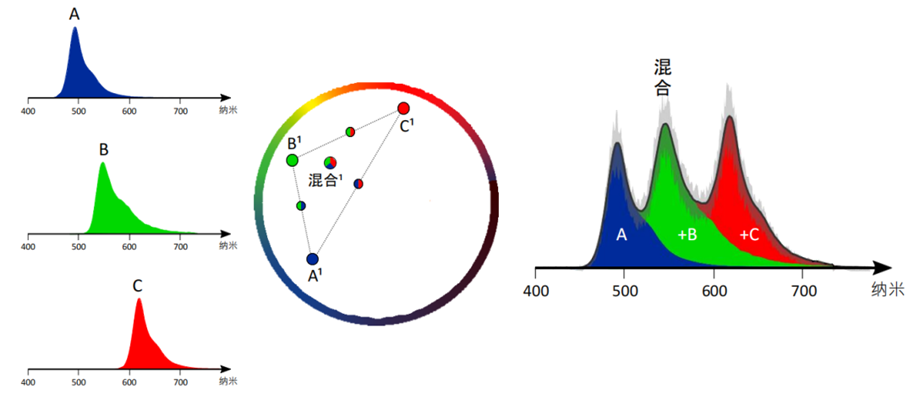
图 3。左侧所示为蓝色、绿色和红色荧光团的三个单独光谱。使用相量分析时,每个纯光谱都落入相量空间中的特定空间,颜色在一个圆圈上表示,信号清晰度决定了与中心(中间面板)的距离。这些荧光团的任意组合也将落入特定空间。图中所示是三个荧光团中的每一个与所有三个荧光团的混合体的一种组合。由于任何可能的荧光团组合也将落入“它们的”空间,因此可将光谱平均化以实现去噪。右侧图是一个例子,其中黑线表示平均值 ± 误差(显示为灰色区域)。降噪光谱表示所有贡献荧光团的总和,它很好地填充了曲线下方的面积。
与单纯基于相量的拆分类似,具有相似荧光组分的所有像素都会落入相同的相量空间。因此,无论空间位置(即图像中的原点位置)如何,它们都可被平均化以实现光谱去噪。这样,通过歧管进行的线性拆分操作次数(像素数,通常在百万像素级别)通常会减到少于100,000次操作。然后对降噪光谱进行线性拆分,由此识别每种染料的亮度值。
与线性方法相比,混合拆分方法利用了基于相量的方法所具有的速度和平均化优势,而不会影响可分离染料的数量。
总结与优势
FluoSync是光学滤色镜的数字迭代进步。这是一种可用于对多种染料成像的可靠方法。由于它只需要单次图像曝光,并且可以使用自动光谱分解方法完成,因此可以更轻松、更快速地进行多色荧光成像。
与传统成像技术相比,FluoSync提供了高速、同步的多通道采集,同时利用了串扰而不是避免串扰。它是扫描大型样本或捕捉活细胞快速动态过程的理想解决方案。最后,使用FluoSync时无需在实验之间管理多组荧光滤色块,从而简化了实验工作流程。因此,您可以专注于获得结果,而不是研究显微镜。
优势
可使用不同的荧光团组合更加自由地进行多通道成像: 您不再受限于使用与显微镜的固定滤光镜组匹配的染料组合。
提升数据生成效率: 能同时采集所有事件而无需管理多组滤光镜,从而加快了图像采集过程,提高了对多孔板等大型样本成像的效率,并且能够捕捉活体样本中的快速事件。
增强信心:使用混合光谱拆分方法意味着您无需再担心串扰。
参考资料:
Digman MA, Caiolfa VR, Zamai M, Gratton E。2008 Jan 15;94(2):L14-6.
F. Fereidouni, A. N. Bader, H. C. Gerritsen, Opt. Express 2012, 20, 12729
Francesco Cutrale, Vikas Trivedi, Le A Trinh, Chi-Li Chiu, John M Choi, Marcela S Artiga & Scott E Fraser. 14, 149–152 (2017)。