徕卡共聚焦讲堂第14讲:通过3D成像和对亚细胞进行色素鉴定描述罗马地下墓穴光合生物膜的特征
人工照明会诱导光合生物膜(黄萎病或maladie verte)的失控生长,从而损坏地下遗迹。为了防止罗马地下遗迹(意大利罗马的St.Callistus和St. Domitilla地下墓穴)发生生物退化或外观损害,人们使用基于荧光光谱法的共聚焦技术来分析单个细胞的荧光色素。该研究可在体内色素识别、生物体形态和生物膜内具有特定荧光特征的细胞的3D定位之间建立同步关系。该技术可比较用绿光(GL)和白光(WL)照射光合生物膜的效果。结果显示在GL的情况下生物膜生长迟缓,表明其可用于文化遗址的照明。

简介
岩石表面生长的微生物会导致艺术品发生不良变化。可导致生物腐烂的生物体会构建复杂的群落结构(被称为生物膜),降低艺术品外观美感并最终导致化学和物理损坏[1]。要对生物腐蚀进行定性和定量表征,需要了解所涉及的基质、生物体和非生物因素[2]。这些信息可帮助管理人员为文化遗产的毁坏[4]选择适当的预防和根除方法[3]。
罗马地下墓穴是一条旅游路线中包含的地下遗迹。因为参观者和使用人工照明的缘故,参观区域受到了严重损坏[5]。我们的最终目标是开发创新的非破坏性技术,以控制和防止岩石表面光合生物膜发生失控生长。
光质量是光合生物膜发育的决定性因素,因为光是光养微生物代谢和发育的基础[6]。由于为游客安装了人工照明,与非旅游景点相比,专用于观光的下层区域遭受了更多的光养活动——因此也有更多生物膜生长。我们使用光谱共聚焦显微镜的lambda扫描,对复杂群落[7]的不同系统发育组(例如绿藻门、硅藻门、含藻红蛋白和非藻红蛋白的蓝藻门)个体生物的荧光特征进行了3D定位和在体区分。
在该研究工作中,我们还评估了几乎不被光合生物利用的单色绿光(GL)对光合生物的适应和生存能力、生物膜结构的影响,并最终评估了其在通常使用人造白光(WL)照明的地下环境中防止生物膜生长的功效。我们选择单色绿光是因为人类视觉对它的灵敏度最高,从而能保留壁画的细节和色彩。
材料和方法
生物膜和照明系统
天然生物膜样品取自经人工照明的地下遗迹的表面(意大利罗马St. Callistus和Domitilla地下墓穴)。样品保存在营养物浓度为10%并用1%琼脂(Merck)固化的2毫米厚BG11培养基层上[8]。将1 g粘杆藻属薄叶嘉赐木 (Rabenhorst) Bornet CCAP1430/3(法国巴黎巴斯德培养物保藏中心)和绿藻Chlorella sorokiniana Shih.& Krauss(Culture Collection of Instituto Isla Cartuja (CSIC)(西班牙塞维利亚))的无菌培养混合物与沉积在上述培养基上的灭菌石灰质板接种,构建人工生物膜。将平板置于培养皿中,在连续绿光(GL) (Narva LT 18 W/017 green TT,捷克共和国Narva)或白光(WL) (Chiyoda F 15 S日光,Chiyoda Corporation,日本)下,在20μmol/m2/s的恒定光子通量密度下保持60天,温度19-22℃。使用LICOR Li-1800(Lincoln,NE,USA)光谱仪测量每个灯的发射光谱。
生物膜结构的可视化
使用Leica TCS SP2在荧光和反射光模式下进行共聚焦扫描。反射模式(在488 nm激发,在480至490 nm发射)可记录源自无机固体材料的反射信号。利用Ar/HeNe激光器的543和633 nm线,在590到800 nm的发射范围内红色通道观察到光合色素的自发荧光。胞外多糖(EPS)用凝集素伴刀豆球蛋白-A-Alexa Fluor 488(Molecular Probes, Inc., Eugene, OR, USA)(0.8 mM终浓度)标记并在绿色通道中观察(在488 nm线激发,在490至530 nm发射)。核酸用DNA选择性染料Hoechst 33258(Sigma-Aldrich,St.Louis,MO,USA)进行特异性染色,并在蓝色通道中观察(在351和364 nm处激发,在400到480 nm处发射)。
我们获得了沿光轴以不同间隔(z步长)获得的x-y平面中的光学切面。使用Imaris软件(Bitplane,瑞士苏黎世)将图像呈现为多通道和3D投影。投影用于描述生物膜内生物体的空间分布以及生物膜厚度和结构的差异。
色素荧光分析:λ扫描
参照Roldán等人的方法[7],进行了单细胞色素鉴定。使用氩激光器的488 nm激光进行波长扫描。使用20 nm的发射带宽扫描相同的x-y光学截面,以此获得每个图像序列(波长扫描)。在最亮的z轴层面获取x-y-l数据集。每个视野使用同样的增益和背景扣除值,并且在整个扫描过程中保持不变。
光谱成分的不同的荧光强度以伪彩来显示(暖色表示最大强度,而冷色表示低强度)。使用Leica Confocal软件2.0版测量x-y-l数据集的平均荧光强度(MFI)。使用软件的感兴趣区域(ROI)功能来确定扫描图像中特定区域的光谱特征。进行荧光分析时,在每个x-y-l图像堆栈中设置了从细胞内的类囊体区域获取的1 µm2 ROI。计算了所有ROI的平均值和标准差。

图1.罗马地下墓穴的两个采样点。a. St.Callistus地下墓穴Cubicolo di Oceano内壁画上生物膜集群的宏观图像。b. St.Domitilla 地下墓穴走廊墙上的灯附近生长旺盛的光合生物膜。

结果——生物体和生物膜结构
来自罗马地下墓穴的生物膜
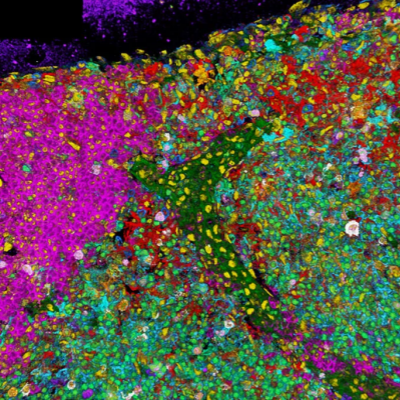
在自然或人工照明区域,形成生物膜的光合微生物在由石膏、壁画、钙华、砖块或砂浆组成的表面上大量生长(图1a、1b)。生物膜(图2)主要包括球菌、丝状蓝藻细菌和苔藓,但也包括硅藻、真菌菌丝和放线菌[9]。生物膜通常为多孔,厚度极不均匀(从80到550 µm),这由自发荧光和EPS的三维投影确定(图2)。对大多数生物膜而言,EPS在上层最为丰富(图3a)。有趣的是,形态相似的光合细胞对伴刀豆球蛋白A的反应随它们在生物膜内的相对位置而变化。
将Hoechst 33258 DNA染色的结果与色素自发荧光研究的结果相结合,可以区分活的光养微生物和异养微生物。核酸染色未见异养菌群扩展。但这些群落在光合色素荧光较弱的区域发育程度较高。反射通道可显示是否有无机硬质基底及其厚度,如钙化鞘(图2c);与自发荧光相结合可以辨别空的钙化鞘
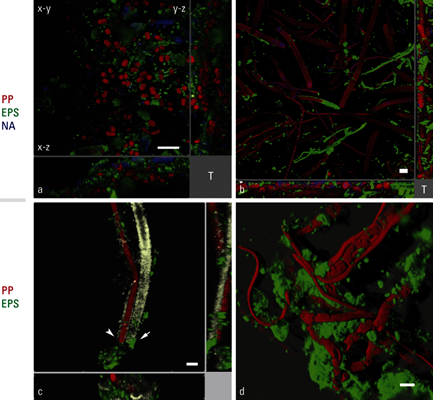
图2.St.Callistus和St.Domitilla地下墓穴(罗马)中形成生物膜的微生物的共焦投影。光合色素(PP),红色;EPS,绿色;核酸(NA),蓝色;以及来自无机材料的反射(REF),灰色。a.以Gloeocapsopsis稠液为主的生物膜。色素荧光显示细胞内的类囊体排列。生物膜厚度= 33.5 µm。b.生物膜以Scytonema julianum和Leptolyngbya sp为主。c.Scytonema julianum的特征是毛状体周围的多糖鞘上有碳酸盐针状物。EPS被恢复为基质和灰色钙化鞘(箭头)。生物膜厚度= 45µm。

图3.由Leptolyngbya sp.形成的生物膜矢状投影,厚度极不均匀。光合色素,红色;EPS,绿色。微生物沿xy轴的分布不规则,生物膜沿xz轴形成基质。a. EPS主要分布在上层。生物膜厚度= 48 µm。b.致密而薄(21.17 µm厚)的生物膜,EPS分布不均匀。T=生物膜表面。比例尺= 10 µm。
人工生物膜
用三维图像对GL或WL光照的人工生物膜结构和组成的变化进行评估,其中光合色素(PP)发出红色荧光,多糖结合Con-A发出绿色荧光(图4)。GL和WL生物膜均分层(图4)。
GL:保存在GL下方的平板包含2到4个膜状粘杆藻细胞簇,周围有较厚的鞘,仅标记Con-A到最古老的外层(图4a)。膜状粘杆藻的液泡化类囊体被视为细胞内的空隙。小球藻几乎不存在,剩余的少数细胞具有微弱的色素荧光。
WL:保存在WL下方的平板显示膜状粘杆藻簇与小球藻的亚球形细胞混合。与GL的情况相比,两种生物体各自的色素荧光更高。有8到16个膜状粘杆藻细胞的密集簇,它们有时会进一步聚集,并被明显致密且强烈标记的鞘包围(图4b)。在WL中生长的生物膜(图4b)比在GL中生长的生物膜(PP厚度= 4.65 ± 0.9 µm)更薄(PP厚度= 3.7 ± 1.53 µm),并且包括一个由小的、不规则密集的G.membranacea菌落组成的致密底层,而小球藻则靠近表面生长。

图4:在GL和WL下方生长的蓝藻生物膜的共焦投影。PP,红色;EPS,绿色;NA,蓝色。a.在GL中生长的膜状粘杆藻菌落。鞘不致密,只有外层被Con-A凝集素标记(箭头)。b.在WL中生长的膜状粘杆藻菌落。细胞被分成多达16个细胞的密集簇,并被致密的鞘(箭头)包围。小球藻主要存在于上层。T=生物膜表面。比例尺= 10 µm。
结果–色素
来自罗马地下墓穴的生物膜
生物膜的共聚焦层扫图像显示了生物膜微生物的深度差异分布(图5)。对于每个生物膜,488 nm激发波长处的相应发射光谱显示在右侧(图5b)。
生物膜BF1:Leptolyngya sp.的细丝水平地排列在宽Scytonema julianum的顶部(图5a)。由于叶绿素a和藻胆蛋白、藻蓝蛋白(PC)和别藻蓝蛋白(APC)的重叠,两种蓝藻细菌都在658.4 ± 3 nm处有宽阔的发射峰(图5b)。此外,由于有藻红蛋白(PE),Leptolyngybya sp.而非S.julianum呈现出发射峰(579.7 ± 3.8 nm)(图5b)。我们没有观察到来自同一类群的特定标本(例如被厚鞘、EPS或钙质覆盖时的Scytonema julianum)的发射峰值变化。
生物膜BF2:CSLM显示有两层。Diadesmis gallica - Bacillariophyta -主要集中在生物膜的顶部(图5a)。由于存在叶绿素c,它们的发射峰值为676.2 ± 5 nm(图 5b),与其他组的发射峰不一致。
尚未确定的Chroo-coccal形成了不连续的底层(图5a),并呈现出与Leptolyngybya sp.(BF1)相同的光谱形状。蓝藻细菌在640到740 nm范围内表现出比Bacillario-phyta更高的平均荧光强度(MFI)(图5b)。由于存在PE,蓝藻细菌在577至580 nm处也呈现出高MFI(图5)。

图5:来自罗马地下墓穴的两种生物膜的CSLM投影和荧光特性。a.每个图像代表在590–775 nm范围内发射的自发荧光(激发波长= 543 nm)。BF1.由Scytonema julianum和Leptolyngbya sp。BF2形成的生物膜。分层生物膜,由两层组成,上层为Diadesmis gallica菌落,下层为Chroococcal菌落。b.来自lambda扫描的每个物种单个细胞的光谱图(激发波长= 488 nm,步长 = 50)。生物膜发射光谱曲线之间的差异表明存在不同种类的藻类和蓝藻细菌。T=生物膜表面。比例尺= 10 µm(发表于:Applied Environmental Microbiology 70 (2004) 3745-3750)。
人工生物膜
在488 nm激发波长处,分别用GL和WL处理的两个样品的MFI(平均荧光强度)和光谱半高宽不同,但光谱形状相同(图6)。
膜状粘杆藻:叶绿素a(约670.7 nm),而WL样品的发射带显著更高(659.3至666.4 nm),对应于藻胆蛋白PC和APC(图6b)。在GL和WL中,当在488 nm激发时,膜状粘杆藻在约580 nm的发射波长下显示PE荧光。
在GL中,波峰位置在685nm处,与光系统PSII发射峰高度一致,另一个次要的最大峰值在730nm,对应光系统PSI发射带。(图6b)。在573.6至590.7 nm(PE发射)和653.6至659.3 nm(PC和APC发射)的发射范围内,发现GL和WL处理样品的MFI之间存在显著差异。我们可以假设GL通过降低荧光的净速率来影响荧光特性。
小球藻:在488 nm的激发波长下,两种处理的样品均未观察到叶绿素a最大值的显著差异(图7)。
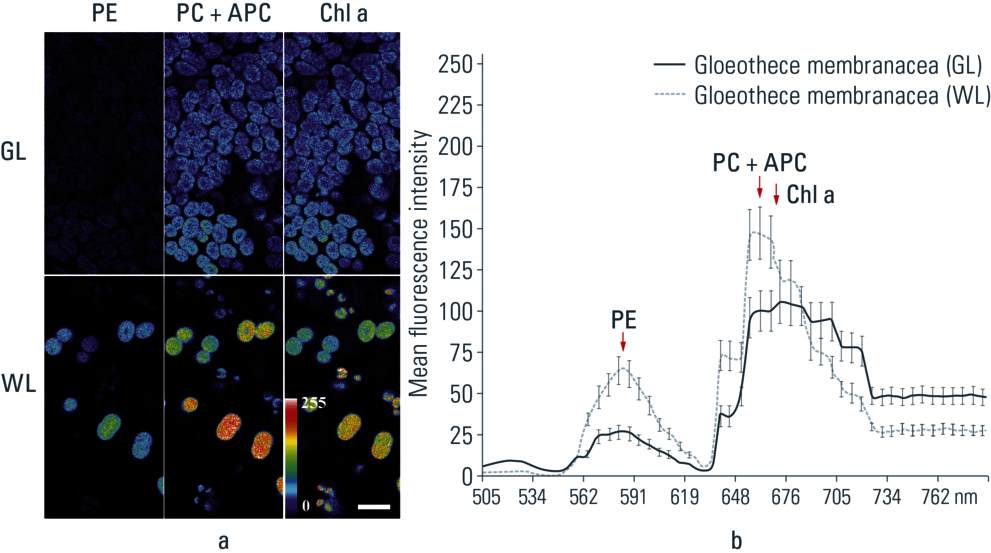
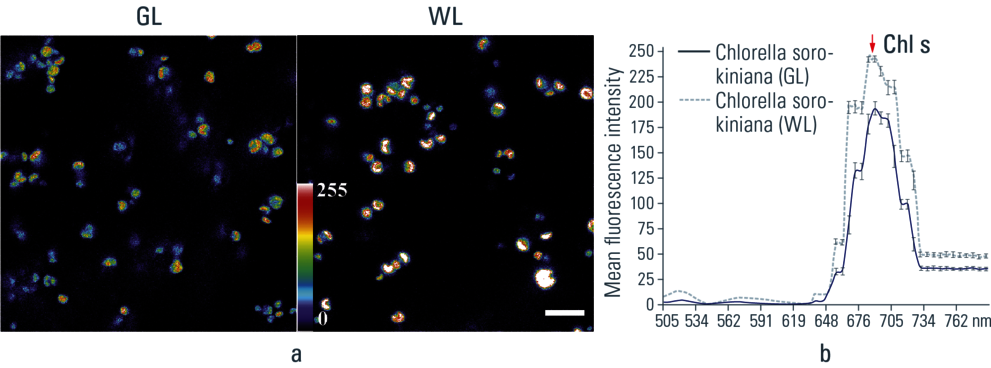
图6:膜状粘杆藻单细胞在不同光(GL和WL)照射后的荧光特性。a.来自lambda扫描(激发波长488 nm,扫描帧数50)的光学切片,对应于叶绿素a和藻胆蛋白(PE,藻红蛋白;PC,藻蓝蛋白;APC,别藻蓝蛋白)的发射峰。b.光谱曲线代表膜状粘杆藻在GL和WL下的平均荧光强度光谱。比例尺= 10 µm(发表于:Applied Environmental Microbiology 72 (2006) 3026–3031)。

图7:小球藻单细胞在不同光(GL和WL)照射后的荧光特性。a.从对应于叶绿素发射峰的lambda扫描(激发波长488 nm,扫描帧数50)中获取的光学切片。b.光谱分布图代表了GL和WL下小球藻的平均荧光强度光谱。注意GL处理的色素平均荧光强度相对于WL对照品的降低。比例尺= 10 µm(发表于:Applied Environmental Microbiology 72 (2006) 3026–3031)。
讨论
有机体和生物膜结构
CSLM是研究微生物分布及其生物退化影响的卓越技术[10]。它已被用于对各种栖息地、地下墓穴[9]和其他光线昏暗的有氧环境(如落水洞和洞穴[11])中的光养生物膜和垫层进行成像。对于生物膜样品,在不同焦深下使用多个激发和检测波长能让我们对分子等目标特定元素(例如DNA和色素)、结构(例如表面、基质、鞘和细丝)和特性(例如细胞分裂、生长和衰老的阶段)进行三维观察。
色素
迄今为止,具有lambda扫描功能的CSLM仅被用于确定新荧光染料或已知荧光染料的发射光谱的最佳检测和分离。在本研究中,我们将CSLM与lambda扫描结合使用,创建了应用范围广泛的强大工具。荧光检测可以根据生理状态[12]和生物量[13]的量化来描述复杂的群落。叶绿素a是一种存在于大多数植物、藻类和蓝藻细菌中的光合色素。此外,大多数蓝藻细菌使用藻胆蛋白(藻红蛋白、藻蓝蛋白和别藻蓝蛋白)来捕获光能。借助lambda扫描功能,属于某一系统发育组的物种显示出在形状和色素发射峰上可与其他系统发育组区分的光谱图谱[7]。该技术的主要特点是:(i) 对全局和单个荧光像素进行分析,提供它们在体内的三维定位;(ii) 在不分离的情况下直接分析厚样品中单个细胞的荧光色素;(iii) 在复杂微生物集合体中建立荧光特性、形态和位置之间的同步关系;(iv) 区分集落内具有特定荧光特征的细胞,以及与单个细胞状态的相关性。
防止生物腐蚀的方法
清除艺术品中的微生物菌落并非易事。大多数去除光养生物膜的处理包括杀菌剂应用,它们通常会产生不良影响。因此,我们迫切需要替代性、低风险的方法[14]。我们认为,控制生物腐蚀的关键是采取措施防止形成有利于微生物群落生长的条件。我们的研究结果表明,大多数光合生物对单色GL的吸收很差,因此,单色GL可用于预防地下环境中的黄萎病。只某些蓝藻细菌能够获得足够的光能,在极其昏暗的环境光或GL中生存,虽然不会旺盛繁殖。[6]。这表明用GL代替WL照亮地下环境会减少苔藓和藻类物种的多样性。
目前我们需要开发技术来监测光养生物膜在自然条件下的生长,,并评估预防性或根除性治疗对生物膜的定性和定量变化。CSLM有利于保护文化遗产,因为它能对极小的样品(例如来自珍贵艺术品的样本)进行活体研究,并提供实时和空间信息。这种方法与白光激光或荧光寿命成像显微镜(FLIM) [16]等新技术相结合,为各种光合微生物的新研究实验扩展了可能性。此外,光谱CSLM还能让我们识别光合微生物在特定波长下的色素[15,17]。我们目前正在利用这些研究结果为面临威胁的文化遗产开发照明替代方案。
致谢
我们感谢Oliva博士对统计计算做出的贡献。本项工作得到了欧盟能源、环境和可持续发展计划在CATS项目框架内的部分支持,合同为EVK4-CT-2000-00028。