从理想到现实 | 一个追光者的STED使用史
李晓明(上海科技大学)
科学和技术的关系是科学史专家们喜欢讨论的课题,它们互相融合、互相促进、互相激发,一起促进了社会的进步。传统的科学史专家偏向认为科学发展是范式转换,经常由深刻的创新思想驱动[1];而近百年或者近五十年来的科技发展也表现出另外一种态势,即新技术打开新的研究领域或新的研究维度。光学成像技术的发展便是其中一个典型案例,这个领域内的进步并非是基础的哲学、数学或物理学上的重大理论突破,而是利用已有理论提高人类研究在空间和时间的分辨率、拓宽研究组分的类别,从而构建出可研究的微观新时空。
科学家(使用者)们对科技的的需求是多元化的,最理想的技术是可以同时检测所有感兴趣组分随在各个时空维度上、各种尺度上的动态变化。另一方面,技术研发者们希望展现他们的技术在某个维度上的极致展现,这需要将技术局限在某个特定时空维度上来展现有限且特定的组分变化。
2009年Nature Milestones历数了光学成像领域从1595年到2006年的技术里程碑,叙述了显微成像技术和标记技术的发展,展现了技术和需求的碰撞一步步推动了科学家们探索多种目标组分在多维度时空的分布和变化的发展史,将自然科学的研究引入了新的时空[2]。而我们也看到了这些技术对科学特别是生命科学的进步起到了极大的推动作用,很多技术应用至今仍然不可或缺。同所有在后来发扬光大的那些技术一样,受激发射损耗显微镜(Stimulated Emission Depletion,STED)超高分辨率成像技术也在研发者和使用者的拉扯中经历了从理想到现实的历程。
STED 的发明
超高分辨带来超高理想
极限就是用来打破的。当阿贝提出分辨极限以后[3],成像科学家们就希望发展从多角度切入以突破光学衍射极限,上世纪九十年代前后涌现出多种超高分辨率显微成像技术,将基于光学成像技术的科学研究慢慢带进了纳米尺度空间。其中,1994年Stefan Hell就发文章阐述了使用受激辐射技术来突破分辨率的理论和STED显微镜搭建理论[4],2001年便报道了使用不同形状的受激幅射光来突破分辨率极限的STED显微镜[5]。这项技术的突破给科研工作者们提供了更高维度的研究可能,获得了2014年诺贝尔化学奖。而STED超高分辨率成像技术也开始了20年来的打怪升级,从给科学家们带来众多科研想法和可能性的研究成果慢慢进化成易用、稳定的成熟商业产品。我们可以看到这项技术从理想到现实、从单维度到多维度的蜕变,STED成像技术应用的领域越来越多,解决的问题越来越复杂。
SP5 时代
从单色STED到多色STED
STED走进市场是2007年SP5时代的TCS STED,我第一次接触已经是几年后的TCS STED CW了。那时候只有双光子和氩离子激光器作为激发光的Pulsed STED和CW STED,受激辐射光好像也只有592nm的激光。现在回头看,那时候的技术只能做折射率适合、592nm光吸收低、标记信号极亮的、激发光为458-514nm之间的荧光样品成像,而这时候商业化产品的官方宣称分辨率只有80nm。
那时候大家试图在百纳米分辨率以内研究细胞组分的相互作用的话,只能选择类似BD Horizon V500和Alexa 488这种极易串色的染料组合,那时候的protocol里甚至还有串色拆分的教程。但是有和无的差别,已经很震撼了,至少研究者们可以尝试在百纳米光学分辨率的空间里进行分析研究了。
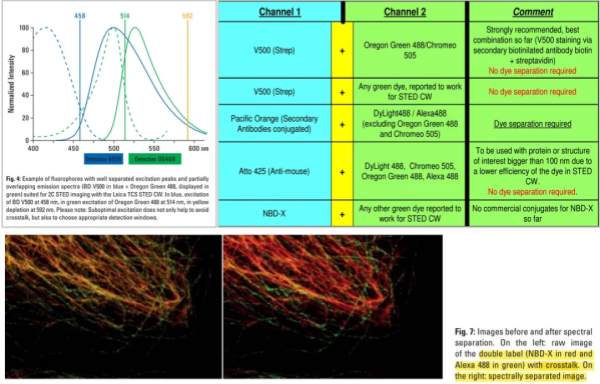
图1. 早期双色STED的protocol
2010年前后,随着STED染料的研发、脉冲白激光的使用和受激辐射激光的选择变多,研究者们发现使用750nm波长的激光器可以对ATTO 647N和 ATTO 655等红外荧光染料进行更有效的光损耗,而且在592nm受激辐射光成像时由样品或封片剂等原因造成的信号模糊也明显减轻了。一方面研究者们可以选择成像效果更好的红外染料进行单色STED,也可以使用750nm和592nm受激辐射光的联用来实现2-3个通道的STED成像了。
SP8 时代
对生物用户使用门槛降低的STED
2016年我的身份由方法学科研工作者转变为平台技术人员,这时期的STED也在前一年进入了SP8平台时代,生物用户们发现基于SP8的STED越来越容易上手了。2014年的诺贝尔化学奖让领域的科研工作者们了解了STED等超高分辨率显微镜技术,而经过十年的发展这时候基于白激光+HyD检测器的SP8新平台已经非常成熟,推出了很多项对生物用户友好的商业化技术。
首先让人印象深刻的就是Gated CW-STED (gSTED)了,gSTED 使用更低的STED激光强度达到了比CW STED更好的分辨率,同时使用基于荧光寿命的时间门控技术用户可以轻松地去掉592nm受激幅射光带来的一些信号损失和模糊,这时候STED的分辨率提升到现在大家熟知的50nm。gSTED技术让生物用户可以使用非常熟悉的EGFP、AF488、mCherry等染料或荧光蛋白进行STED成像。虽然很多常用成像探针无法将STED效果发挥到极致,但是对于生物学家而言,他们更偏向于不必换实验体系就能实现研究目的。这是荧光寿命技术最初在STED商业化产品中的应用,最近几年这个领域又有很多进展,一直持续不断给使用者们带来惊喜。
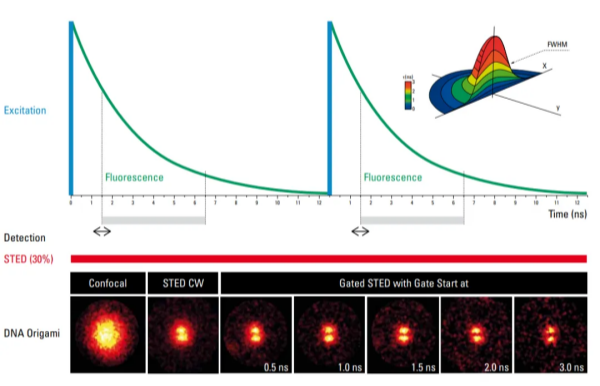
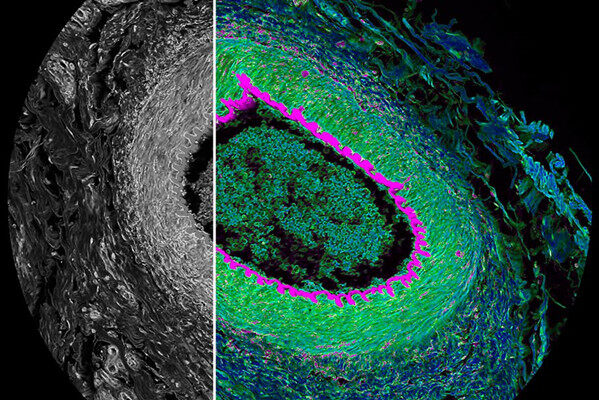
图2. gSTED对成像效果的改善
2016年我们单位购置了第一台受激发射耗损显微术,型号是TCS SP8 STED 3X。这时候红外荧光染料对应的受激幅射光已经从750nm的连续激光升级成了775nm的脉冲激光,我们发现775nm的STED成像分辨率远高于以前的任何波长的受激幅射光,在普通生物样品中最佳分辨率竟然可以达到30-40nm。更神奇的是775nm的受激幅射光不再有连续受激辐射激光“一扫没”的现象(592/660nm连续激光扫过样品一次以后很多常见荧光探针淬灭现象严重,俗称“一扫没”),我们甚至可以使用775nm的STED成像模式进行预览来找到更合适的拍摄位置、甚至还可以进行多层Z STACK扫描、甚至还可以做点活细胞STED成像。与之对应的是,这时候受激幅射光的形状调制也引入了新方法,除了在xy维度上可以提升分辨率,z轴维度上也可以使用3D STED技术来提高分辨率了。
至此,对普通生物用户而言,如果使用775nm友好的红色和红外染料,这时的双通道STED成像和常规共聚焦一样简单了;这些染料和gSTED联用可以实现更多通道的STED成像。而最近几年荧光染料的发展涌现了很多long stoke位移的荧光染料,比如abberior STAR 460L、abberior STAR 520L等,也可以使用775nm的脉冲激光作为受激幅射光进行3-5色的STED成像。这些成像和制样技术的进步使得制样难度大大降低。而同一时期,我们也开始了从纯化染色质到细菌、细胞、脑片、线虫和完整果蝇脑等较广泛生物样品的STED成像[6-9]。
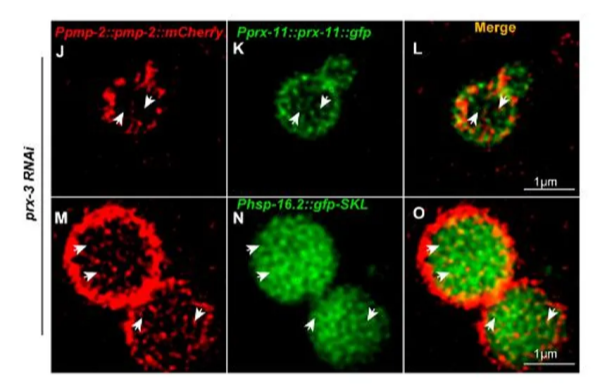
图3. STED在线虫过氧化物酶体中的应用
STELLARIS 时代
光毒性更小、通道更多
虽然基于荧光寿命的STED性能提升在SP8时代已经开启,但是真正作为独立实用工具的推出是在2020年前后的STELLARIS平台。在gSTED通过简单设置hyD检测器门控时间的基础上,研究者们发现优化FLIM数据的分析可以进一步地提高STED的成像分辨率。在荧光光子数和分辨率平衡的基础上,FLIM-STED达到相应的分辨率只需要使用传统STED 1/3到1/4的损耗光强度来成像便可达到常规STED的成像效果。因此,这种TauSTED技术可以在较厚样品成像中对z轴采集更多层的信号,也可以在活细胞成像中采集更多帧数,进一步拓宽了成像应用范围。
与之相应的,不同STED显微镜厂家也改进了STED技术在厚样品成像中应用,使用更适合生物样品折射率的甘油物镜、硅油物镜或者水镜以及特别的照明方式,让使用者更容易对样品较深的位置进行STED成像或者进行更厚的信号采集。2023年,有实验室报道了使用硅油物镜对19.3x15x6 μm3的较厚活脑片进行xyzt 4维成像,为光学成像技术在突触分辨率水平对活体大脑组织进行动态功能研究打开了新的研究途径[10]。
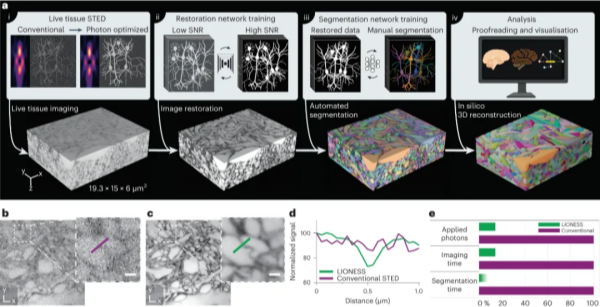
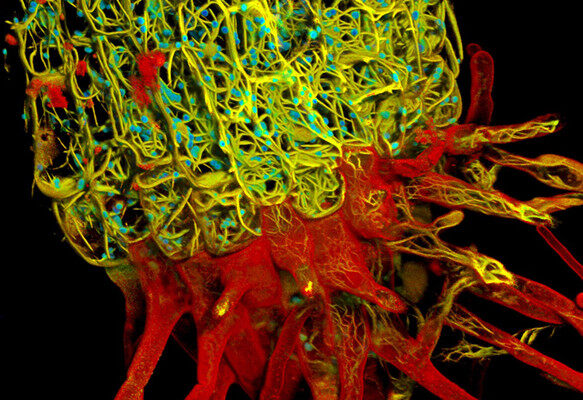
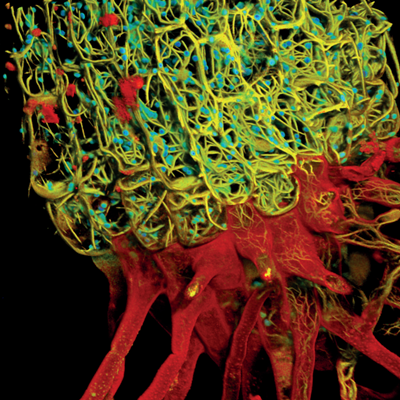
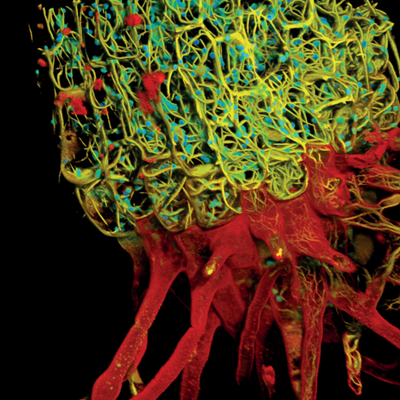
图4. 3D STED技术在信号密集的活体厚脑片成像中的应用
除此之外,基于荧光寿命光谱拆分的成像方法最近二十年也一直是成像领域的研究热点。早在2017年Hell团队就报道了使用612 nm的激发光和 775 nm的受激幅射光对ATTO 594、Abberior STAR 635P、KK1441、CF680R标记的样品进行STED成像并进行光谱拆分得到多通道成像结果的方法[11]。随着近几年光谱向量拆分技术的成熟,使得这个方法对不同通道信号亮度的差异越来越宽容,常规生物样品即可进行5-6色的拆分[12]。
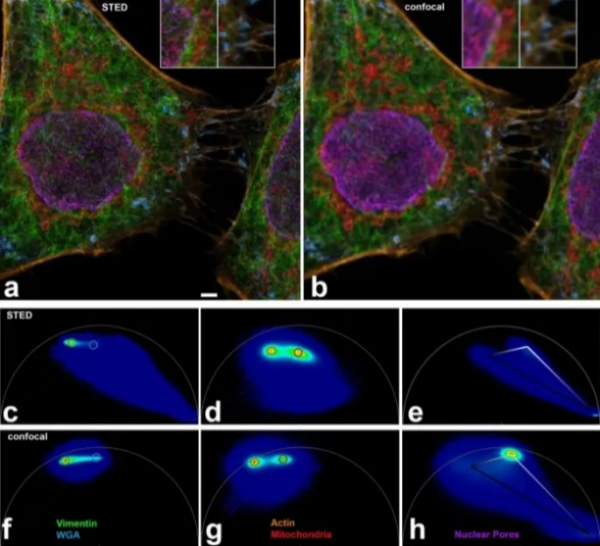
图5. 基于向量拆分的5色STED成像
STED 标记技术的发展
除了仪器的进步之外,标记技术的进步也在推动着STED成像技术在科学研究中的应用[13]。理想的STED荧光探针应该在受激辐射成像区域内完全耗尽且尽量低的产生噪声,亦不需要使用太强的受激辐射激光,从而提高STED的分辨率并减少 STED 带来的光漂白,因此荧光探针的理化性质对STED在科学研究中的广泛应用影响巨大。最初的STED应用中,研究者们主要筛选适合进行STED成像的传统荧光染料或荧光蛋白,主要有BD Horizon V500、NBD-X、Alexa 488、eYFP等。
很快大家发现传统荧光探针在实际应用中遇到一些挑战,需要从以下几点来开发更适合STED成像的荧光探针:
1、提高光稳定性。
2、提高STED损耗效率。
3、降低受激辐射损耗背景噪音。
4、提高生物相容性。
5、减少受激幅射光对其他荧光探针的淬灭。
6、降低标记方法带来的定位精度偏差。
基于这些需求,研究者们开发出了STED友好的荧光蛋白 (iRFP、TagRFP657、mNeptune2、mGarnet2等)、STED友好的有机染料(Star家族、SiR等,可连接到抗体上也可以用HaloTag 或SNAPTag靶向到活细胞内的蛋白质)、避免被592nm或660nm强激光漂白的long stoke位移的荧光染料和标记物和目标区域距离更小的纳米抗体等,使得STED技术更加广泛地应用到生物研究中。
总结和展望
作为一种对图像重构技术依赖较小、且样品制备相对简单的纳米显微成像技术,STED得到了很多生物学研究者们的青睐,在二十多年的技术发展和应用中不断迭代,应用到越来越多的领域,也取得了很多成就,为推动生命科学研究在纳米空间拓展做出了很多的贡献。
但是由于受激辐射相关的分辨率提高技术对荧光分子标记密度和均匀性要求较高,在分辨率极限附近我们经常需要使用电镜等技术进行验证。而在活细胞或厚样品成像中,光毒性和光淬灭依然是需要进一步解决的问题,这有赖于成像技术、标记探针和制样方法等多方面的进步。技术在现实领域中推广时总是会遇到复杂维度的需求,期待STED技术在现实样品应用中带来更多贡献。
参考文献:
1.托马斯.库恩 科学革命的结构【M】 金吾伦、胡新译 北京:北京大学出版社2017
2.Milestones in light microscopy. Nat Cell Biol. 2009 Oct;11(10):1165.
3.Abbe E. Beiträge zur Theorie des Mikroskops und der mikroskopischen Wahrnehmung. Arch. Für Mikrosk. Anat. 1873;9:413–468.
4.Hell SW, Wichmann J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy. Opt Lett. 1994 Jun 1;19(11):780-2.
5.Klar TA, Engel E, Hell SW. Breaking Abbe's diffraction resolution limit in fluorescence microscopy with stimulated emission depletion beams of various shapes. Phys Rev E Stat Nonlin Soft Matter Phys. 2001 Dec;64(6 Pt 2):066613.
6.Zhou S, Xiang H, Liu JL. CTP synthase forms cytoophidia in archaea. J Genet Genomics. 2020 Apr 20;47(4):213-223.
7.Li N, Hua B, Chen Q, Teng F, Ruan M, Zhu M, Zhang L, Huo Y, Liu H, Zhuang M, Shen H, Zhu H. A sphingolipid-mTORC1 nutrient-sensing pathway regulates animal development by an intestinal peroxisome relocation-based gut-brain crosstalk. Cell Rep. 2022 Jul 26;40(4):111140.
8.Fang YF, Li YL, Li XM, Liu JL. Super-Resolution Imaging Reveals Dynamic Reticular Cytoophidia. Int J Mol Sci. 2022 Oct 2;23(19):11698.
9.Wang T, Shi S, Shi Y, Jiang P, Hu G, Ye Q, Shi Z, Yu K, Wang C, Fan G, Zhao S, Ma H, Chang ACY, Li Z, Bian Q, Lin CP. Chemical-induced phase transition and global conformational reorganization of chromatin. Nat Commun. 2023 Sep 9;14(1):5556.
10.Gonzalez Pisfil M, Nadelson I, Bergner B, Rottmeier S, Thomae AW, Dietzel S. Stimulated emission depletion microscopy with a single depletion laser using five fluorochromes and fluorescence lifetime phasor separation. Sci Rep. 2022 Aug 18;12(1):14027.
11.Gonzalez Pisfil M, Nadelson I, Bergner B, Rottmeier S, Thomae AW, Dietzel S. Stimulated emission depletion microscopy with a single depletion laser using five fluorochromes and fluorescence lifetime phasor separation. Sci Rep. 2022 Aug 18;12(1):14027.
12.Velicky P, Miguel E, Michalska JM, Lyudchik J, Wei D, Lin Z, Watson JF, Troidl J, Beyer J, Ben-Simon Y, Sommer C, Jahr W, Cenameri A, Broichhagen J, Grant SGN, Jonas P, Novarino G, Pfister H, Bickel B, Danzl JG. Dense 4D nanoscale reconstruction of living brain tissue. Nat Methods. 2023 Aug;20(8):1256-1265.
13.Jeong S, Widengren J, Lee JC. Fluorescent Probes for STED Optical Nanoscopy. Nanomaterials (Basel). 2021 Dec 22;12(1):21.