成像创新技术是癌症治疗的秘密武器吗?
药物发现越来越得益于利用人工智能(AI)技术发现的新的科学见解。特别是在显微成像领域,由人工智能和机器学习驱动的解决方案加深了人们了对生物学的理解,以及提供了前所未有见解——患者对临床治疗将会表现出什么样的反应。同时,这也为突破性疗法和精准医学的发展提供了新思路。
在癌症研究和免疫疗法领域,这种趋势更为明显。近年来,这一领域取得了突破性的进展,科学家们更加深入的了解到导致细胞异常增长的机制。显微成像技术和免疫组化(IHC)已经成为肿瘤诊断的核心手段,可以显示肿瘤组织样本中细胞的分布和密度之间的关系。
这些病理学的信息有助于临床治疗策略的制定,并且在个性化肿瘤治疗中发挥着越来越重要的作用。为了更好的利用现有的治疗方案治愈患者以及提升新药发现的脚步,科学家们需要解析在肿瘤微环境(TME)中细胞的作用和相互关系。这些信息将是阐明疾病的发病机制以及制定更好的治疗方案最重要的基础1,2。
肿瘤组织的异质性研究可以帮助科研工作者更好的理解甚至预测肿瘤的形成、治疗效果和临床结果,但是却是科学家们长期以来难以攻破的难题。将肿瘤微环境进行可视化的障碍并不在于显微成像技术本身——徕卡拥有世界上最高超的显微成像技术3。它的难点就在于分析和使用显微成像技术获取的数据。随着计算生物学的出现,这为理解复杂生物学和病理学开启了一个全新的研究通道。我们也终于可以向破解癌症之谜和如何成功战胜它迈出新的一步。
超多重免疫荧光成像技术的兴起
传统的免疫荧光技术(偶联荧光素的抗体探针用于标记蛋白质)通常仅限于在每个组织切片上显示最多7个生物标记物,主要用于可视化肿瘤组织病理,以达到诊断目的3,4。此外,定量的方法往往依赖于半定量技术,该技术受到非线性生物标志物染色强度、人为观察之间的不同和实验操作流程之间不同的限制。
为了打破这些限制,历经十多年开发的方案可以让科学家们能够使用多重荧光技术(MxIF)进行实验。该技术可以在单个组织切片上标记60多个生物标志物并且可以更清楚的识别单个细胞3。
然而,这些大部分是很复杂的手动方案,很难标准化,既耗时也耗财力。为了解决这些困难,高通量多重免疫荧光染色方案和标准的荧光定量分析技术已经面向于世,用于高度可重复性、高效、高投入产出比的组织成像4,5。先进的基于人工智能(AI) 和机器学习 (ML)算法的图像采集和分析软件,结合自动化和简化工作流程的多重免疫荧光成像系统,已经能够让研究人员更好地理解肿瘤细胞的特性和相互作用,以及它们是如何与临床需求相互结合3,5-9。
揭示高度特异性肿瘤组织中的“同质化模式”
在一项使用多重免疫荧光技术探究转移性黑色素瘤肿瘤异质性成因中7。研究人员使用到了来自徕卡显微系统的Cell DIVE超多标组织成像分析整体解决方案该系统可以让研究人员通过循环染色的方法在一张切片中标记21种生物标志物来表征细胞个体,完整的保存肿瘤切片的空间位置信
息5,7。
该系统还包括自动成像、先进图像处理技术和采集软件以及用于成像分析的专有机器学习的算法。这些处理技术可实现校准光路、去除自身荧光、图像校准、分割细胞、定量生物标志物以及对细胞类型进行分类,从而使得切片、活检和实验之间标准化。
Cell DIVE超多标组织成像分析整体解决方案结合了单细胞蛋白表达和空间分布数据,结合进一步的统计算法分析能够阐明肿瘤和免疫细胞之间的数量和空间分布以及相互关系7。MxIF研究显示,特异性肿瘤组织中既有一些T细胞浸润严重的区域,也有一些T细胞浸润轻微的区域。此外,这些区域的细胞组分和空间分布也有很大的差异7。这是一个重大的发现,因为大量的T细胞浸润与人类免疫系统攻击肿瘤有关,而轻微的浸润可能表明肿瘤成功地避开了宿主免疫系统。
该研究还观察了肿瘤细胞对人类白细胞抗原(HLA)的表达,已知这种抗原能吸引T细胞攻击肿瘤,并在逃避免疫攻击的肿瘤中关闭10,14。他们发现尽管这是事实,但HLA的单独表达不足以发生T细胞浸润7。相反,其他免疫细胞,如B细胞,似乎也在决定T细胞浸润的程度方面起着重要作
用7。
识别潜在的癌症治疗靶点
最近的一项研究探究了肿瘤细胞的异质性,这一次利用Cell DIVE超多标组织成像分析整体解决方案,结合基因组和磁共振成像(MRI)分析,使用43种标志性癌症生物标志物,揭示野生型弥漫性胶质瘤肿瘤和含有异酸脱氢酶(IDH)突变胶质瘤之间异质性的差异8。
Cell DIVE超多标组织成像分析整体解决方案的 图像数据进行的空间分析和聚类分析显示在IDH突变肿瘤中标志性肿瘤蛋白的表达普遍低于野生型肿瘤。结合外显子组、RNA测序和MRI数据,与突变型肿瘤相比,野生型肿瘤血管生成增强结果一致。基因表达的数据还表明,IDH突变肿瘤的标志性癌症基因(例如用于复制永生,逃避生长抑制因子以及诱导血管生成)具有显著低表达的趋势。这些结果与以下发现相一致:携带IDH突变的神经胶质瘤患者比没有突变的神经胶质瘤患者的总体存活时间更长18,15。
用于转化医学研究的超多标成像
最近两项研究借助MxIF技术解释和了解肿瘤和癌症生物学的复杂性,—— Cell DIVE超多标组织成像分析整体解决方案可实现的生物标志物研究的数量已超过了60(实际的上限远不止这个)5,7,8。其他研究人员正在应用MxIF来更好地了解临床研究中的治疗效果,这不仅可能阐明治疗机制,还可能最终为临床中的个性化治疗决策提供信息9。
为了有效利用MxIF技术在转化研究以及用于癌症患者临床实践,我们需要在计算建模、预测分析以及ML/AL上进行技术创新和投资的变革,聚焦于获取 MxIF数据并且用它理解导致肿瘤形成和进展的细胞变化。如果我们现在在这些技术上加大投入,相信过不了多久就可以预测这些变化,然后采取行动阻止它们。
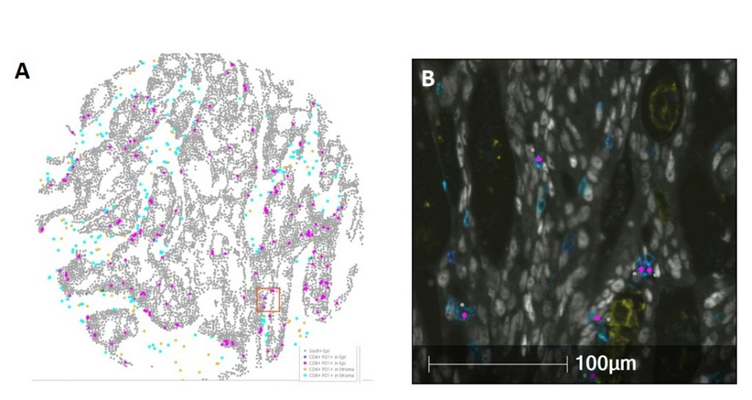
邻近分析可以让研究人员确定PD1+T细胞与肿瘤细胞的相对位置。(A) 上皮和间质内结肠肿瘤细胞(SOX9+;灰色)与免疫细胞表型 CD4+ PD1+(绿色和黄色)或 CD8+ PD1+(紫色、青色)的 HALO 空间分析。(B)肿瘤浸润CD8+ PD1+ 细胞(青色)和Sox9+ 肿瘤细胞(灰色)之间的邻近分析。CD8+ PD1+ 细胞中心(紫色的圆圈)和SOX9肿瘤细胞中心(灰色圆圈)之间的距离和表型计数。
关于作者
参考文献
References
1. GE Healthcare. Clarient, A GE Healthcare Company, Introduces First Lab Developed Test To Assess Multiple Proteins at Single-Cell Level. Press release. Jul 10, 2013. https://www.ge.com/news/press-releases/clarient-ge-healthcare-company-introduces-first-lab-developed-test-assess-multiple (accessed Sep 29, 2021).
2. GenomeWeb. GE Healthcare’s Clarient, GSK Creating Clinical Lab Network to Improve Cancer Dx. Sep 30, 2014. https://www.genomeweb.com/diagnostics/ge-healthcares-clarient-gsk-creating-clinical-lab-network-improve-cancer-dx (accessed Sep 29, 2021).
3. Gerdes MJ, Sevinksky CJ, Sood A, et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proc Natl Acad Sci USA. 2013; 110(29): 11982–11987. doi: 10.1073/pnas.1300136110.
4. Tan WCC, Nerurkar SN, Cai HY, et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Commun (Lond). 2020; 40(4): 135–153. doi: 10.1002/cac2.12023.
5. Leica Microsystems. Cell DIVE multiplex imaging solution. Products. https://www.leica-microsystems.com/products/light-microscopes/p/cell-dive/ (accessed Sep 29, 2021).
6. Lindner AU, Salvucci M, Stachtea X, et al. Abstract LB-088: Exploratory multiplex tissue image analysis of the impact of heterogeneity in the microenvironment of primary colorectal cancer on apoptosis markers in patients. Cancer Res. 2019; 79 (13 Supplement): LB-088. doi: 10.1158/1538-7445.AM2019-LB-088.
7. Yan Y, Leontovich AA, Gerdes MJ, et al. Understanding heterogeneous tumour microenvironment in metastatic melanoma. PLoS One. 2019; 14(6): e0216485. doi: 10.1371/journal.pone.0216485.
8. Berens ME, Sood A, Barnholtz-Sloan JS, et al. Multiscale, multimodal analysis of tumour heterogeneity in IDH1 mutant vs wild-type diffuse gliomas. PLoS One. 2019; 14(12): e0219724. doi: 10.1371/journal.pone.0219724.
9. Rajan A, Heery CR, Thmas A, et al. Efficacy and tolerability of anti-programmed death-ligand 1 (PD-L1) antibody (Avelumab) treatment in advanced thymoma. J Immunother Cancer. 2019; 7(1): 269. doi: 10.1186/s40425-019-0723-9.
10. Gonzalez H, Hagerling C, Werb Z. Roles of the immune system in cancer: from tumour initiation to metastatic progression. Genes Dev. 2018; 32(19–20): 1267–1284. doi: 10.1101/gad.314617.118.
11. Sood A, Kenny, KB., Natarajan, A., Kaanumalle, LS. Method of analyzing an H and E stained biological sample. US patent 9176032B2. Mar 6, 2011. Leica Microsystems CMS GmbH.
12. al AS-Pe. Robust single cell quantification of immune cell subtypes in histological samples. 2017 IEEE EMBS International Conference on Biomedical & Health Informatics (BHI), Orlando, FL, 2017. 2017: pp. 121–124.
13. Sood A, LaPlante NE, Sevinsky CJ, Li Q, Santamaria-Pang A. Method and system for classification and quantitative analysis of cell types in microscopy images. US Patent 9,984,199. May 21, 2015. General Electric.
14. Oldford SA, Robb JD, Codner D, et al. Tumour cell expression of HLA-DM associates with a Th1 profile and predicts improved survival in breast carcinoma patients. Int Immunol. 2006; 18: 1591–1602. doi 10.1093/intimm/dxl092.
15. Carrillo JA, Lai A, Nghiemphu PL, et al. Relationship between tumour enhancement, edema, IDH1 mutational status, MGMT promoter methylation, and survival in glioblastoma. AJNR Am J Neuroradiol. 2012; 33(7): 1349–1355. doi: 10.3174/ajnr.A2950.